El modelo del continuum fue propuesto por Cook y Purdam en 2009 con el propósito de mejorar la comprensión del complejo marco que rodea la patología del tendón. El concepto se basa en las características de los tres estados tisulares del tendón: tendón reactivo, tendinopatía desestructurada y tendinopatía degenerativa. El concepto del continuum se diferencia de las otras propuestas por su visión de cambio continuo de la estructura del tejido tendinoso. Cada fase tiene una presentación clínica característica y un tratamiento específico. Estudios histológicos, por la imagen y clínicos corroboran con evidencia el abordaje de esta patología mediante el concepto del modelo de continuum.
Cook and Purdam first proposed the Continuum model in 2009, with the aim of improving the understanding of the complexity of tendon pathologies. The Continuum is based on three states of tendon structure: reactive tendon, tendon disrepair and degenerative tendon. In contrast to other proposals, the Continuum model describes continuous changes in tendon structure. Each state of tendon structure represents a particular clinical presentation and requires a particular type of management. Evidence seen in histopathological studies, imaging and clinical studies all support the Continuum model for the analysis of tendon pathologies.
Introducción
La tendinopatía es una lesión por sobreuso común que se presenta en la extremidad inferior y superior, causando dolor y pérdida de funcionalidad1. Como parte de la patología de la tendinopatía se han observado cambios en la estructura del tendón que afectan negativamente a la capacidad de carga y tolerancia del tendón.
Las tendinopatías se producen en diferentes partes del cuerpo. Las más frecuentes son las tendinopatías del tendón de Aquiles y del rotuliano2, y se caracterizan por presentar un dolor muy localizado, asociado con altas cargas recibidas por el tendón. Otras regiones comunes donde se producen las tendinopatías son: pubis (aductores), hombros (manguito rotador), codo (complejo extensor) y cadera (glúteos). En términos generales, el dolor se localiza en la inserción del tendón o en las estructuras adyacentes, en la prominencia ósea (tendón rotuliano y glúteo), aunque también puede darse en porciones medias (tendón de Aquiles).
Se conoce que las cargas pueden tener consecuencias positivas y negativas para los tendones3. Una carga puede ser de tipo tensil, de cizalla o compresiva, afectando en la homeóstasis del tendón4. El mecanismo de almacenamiento y liberación de energía del tendón de forma repetitiva, junto con la compresión, parecen ser factores clave en la aparición de tendinopatías4. La cantidad de carga que se necesita para desarrollar patología es dependiente de las características de los individuos, de su capacidad de tolerar cargas (en tendón, y en estructuras adyacentes), de los programas de entrenamiento y cargas de trabajo, además de factores intrínsecos como la edad, el género, la genética, la adiposidad y otras condiciones médicas5.
A pesar del aumento de estudios en este campo, en los tratamientos de las tendinopatías no se consideran los factores que se mencionan anteriormente, y siguen basándose en tratamientos pasivos que no desarrollan una mejor capacidad del tendón para tolerar cargas. Asimismo, muchos tratamientos se centran en la disminución del dolor, sacrificando la necesidad de optimización del tendón, del músculo, de la cadena cinética, y olvidándose de restablecer los cambios neuronales. Centrarse en la eliminación del dolor sin considerar los factores contribuyentes o los signos patognomónicos de la tendinopatía resultará en una recurrencia del dolor. Este artículo remarca la importancia de las cargas en el tendón, además de analizar la evidencia más reciente de la patología de tendón. Se presentará un modelo del desarrollo y del proceso anatomopatológico que hay detrás de esta condición, anteriormente publicado en inglés en 2009, para asistir a los terapeutas en esta lesión.
Modelos patoetiológicos y conceptos de la patología del tendón
En la patología del tendón se han descrito varios estados patológicos. Hace años, la tendinopatía se consideraba como un proceso degenerativo con cambios estructurales irreversibles en el tendón6, especialmente los que presentaban desintegración del colágeno de la matriz y cambios degenerativos celulares. Otras propuestas han sugerido que la tendinopatía ocurre en una fase de regeneración del tendón, con la presencia de células activas y un aumento en la producción de proteínas7. A este fenómeno también se le ha asociado un fallo de la regeneración, con la presencia de desorganización de la matriz celular y de neovascularización, presentes en tendinopatías8,9. Crear un modelo experimental que reproduzca una relación entre cargas y patología tendinosa puede ser complejo, además de la dificultad en construir ese modelo de forma robusta y simple que contemple todos los aspectos y fases de las tendinopatías.
Diferentes modelos se han descrito sobre la etiopatogenia de las tendinopatías7,10-13. Todos ellos se pueden dividir en tres categorías, basadas en los procesos histológicos siguientes: a) degradación/rotura del colágeno; b) inflamación, o c) respuestas de la célula tendinosa. Otros modelos han intentado integrar el sistema nervioso central y el dolor con la patología14,15; sin embargo, ninguno de estos modelos ha considerado la posibilidad de un proceso continuado.
Un nuevo modelo de patología del tendón
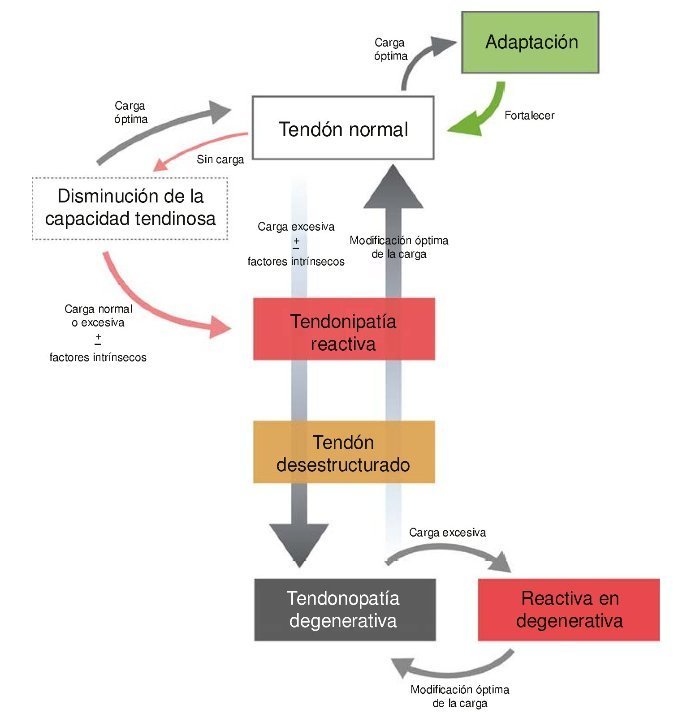
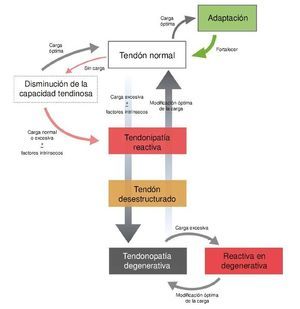
El primer modelo presentado del continuum fue publicado en inglés en el año 200910 y fue actualizado en 201616. El modelo del continuum se describe como un proceso continuado en la patología del tendón, basado en las características de tres estados tisulares: tendinopatía reactiva, tendón desestructurado y tendinopatía degenerativa (fig. 1). Para una mejor descripción el modelo es definido en fases distintas, aunque ocurre como un proceso continuo entre las tres fases. Dichas características clínicas están indicadas seguidamente.
Figura 1 Modelo del continuum de la patología de tendón. El modelo destaca la transición en las fases tempranas de la tendinopatía, siendo irreversible en la fase degenerativa.
Fases del tendón
Tendinopatía reactiva
Las tendinopatías reactivas ocurren por sobrecargas agudas de fuerzas tensionales o de compresión, y por definición no tienen respuesta inflamatoria de la célula. Clínicamente, las tendinopatías reactivas son el resultado del aumento repentino de actividades físicas a las que el tendón está poco acostumbrado17, aunque también se podrían dar claramente después de una contusión directa18. Igualmente, las tendinopatías podrían ocurrir en tendones que han estado expuestos a cargas altas, después de un periodo en descarga17, en un deportista desentrenado después de un periodo de lesión, o un individuo sedentario que incremente su actividad física.
A nivel microscópico, la tendinopatía reactiva se describe como una respuesta hiperactiva celular a la carga. El número de células tendinosas aumenta dramáticamente, las células se redondean y el índice metabólico crece significativamente en los proteoglicanos grandes (como el agrecano). El agrecano es altamente hidrófilo, por lo que atrae agua al interior de la matriz celular y se observa un aumento de agua19.
Es importante señalar que no se observan cambios en la matriz celular en esta fase. Cook et al.20 demostraron que la morfología alterada de la célula era el único cambio histopatológico observado de manera aislada, sugiriendo así que los cambios patológicos en la célula y en la matriz no fibrilar procedían a la desorganización del colágeno. Se cree que este cambio a corto plazo ocurre tan rápido como adaptación de la carga recibida (disminuyendo el estrés del tendón y aumentando su diámetro transversal), aunque a largo plazo pueden ocurrir cambios estructurales y en las propiedades mecánicas del tendón. En imágenes diagnósticas se aprecia como el tendón aparece abultado con un aumento de diámetro, aunque no existen signos de desorganización de la matriz celular21. El tendón tiene el potencial de volver a su estado normal si la sobrecarga se reduce lo suficiente, o si lo permite el tiempo necesario entre sesiones de entrenamiento.
Tendón desestructurado
La fase de tendón desestructurado se ha descrito como recuperación fallida, con la presencia de mayor desorganización de la matriz celular que en el tendón reactivo. Es la fase de desarrollo y progresión de la desestructuración fibrilar; la fase del tendón desestructurado es el paso intermedio entre tendón reactivo y tendón degenerado.
Se produce un aumento generalizado del número de células, así como un aumento significativo en la producción de colágeno y proteoglicanos. Consecuentemente, se produce el inicio de la separación del colágeno y la desorganización de la matriz celular. En este momento no se observan imágenes visibles de cambios en la vascularización interna o neovascularización (p. ej., ecografía doppler). Los cambios en la imagen reflejarán la desestructuración de la matriz, con discontinuidad de los fascículos de colágeno y pequeñas áreas delimitadas hipoecoicas vistas en ecografía. En resonancia magnética (RM) el tendón se observará engrandecido, con un incremento de señales en el tendón.
El tendón desestructurado es asintomático, no presenta dolor y solo sería reconocible usando diagnóstico por la imagen, por lo que no suele verse en la práctica clínica. Se creía que la fase del tendón desestructurado se distinguía por la reversibilidad del tendón; sin embargo, actualmente se conoce por ser una fase puramente de estado patológico, con la ausencia de cambios en la vascularización como única diferencia de un tendón degenerado.
Tendinopatía degenerativa
La tendinopatía degenerativa está ampliamente descrita en la literatura como una progresión de la desorganización de la matriz de colágeno, cambios en las células y aparición de neovascularización9. Aparecen áreas de muerte celular por apoptosis, trauma o fallo de los tenocitos22. La capacidad de reversibilidad de los cambios patológicos es muy remota23. En ecografía, los tendones con signos degenerativos aparecen como imágenes hipoecoicas y frecuentemente contienen un gran número de grandes vasos visibles en modo doppler. En RM se pueden apreciar cambios localizados, con aumento de la señal intratendinosa. Tendones con porciones de tejido degenerado pueden también presentar zonas de tejido sano, que se pueden observar con ecografía de caracterización del tejido (ultrasound tissue characterization [UTC]). La evidencia actual con el uso del UTC sugiere que el tendón patológico podría adaptarse en las zonas de desorganización aumentando su tamaño y asegurándose suficientes zonas de tejido sano para compensar el área de desorganización24. Las zonas de desorganización tisular no muestran ninguna estructura fibrilar alineada, siendo incapaces de soportar cualquier tipo de estrés tensil, por lo que se cree que son mecánicamente inservibles. De esta manera, el tendón hipertrofiado o engrosado, hipotéticamente, es una adaptación positiva de la zona de tejido degenerado para poder mantener la capacidad de cargas tensiles.
Se cree que el paciente con tendinopatía puramente degenerativa no presenta clínica hasta que es sometido a una sobrecarga y precisa de atención médica, presentando un cuadro de reactividad en tendón degenerado (siendo sobrecarga de la parte funcional y sana del tendón degenerado). Si la degeneración del tendón es suficientemente extensa y se somete a cargas altas podría darse la rotura el tendón25, confirmando que el 97% de las roturas tendinosas experimentan cambios degenerativos26. Es importante, y merece la pena señalarlo, la falta de relación entre dolor y patología, ya que muchas roturas tendinosas son asintomáticas.
Presentación clínica del tendón doloroso
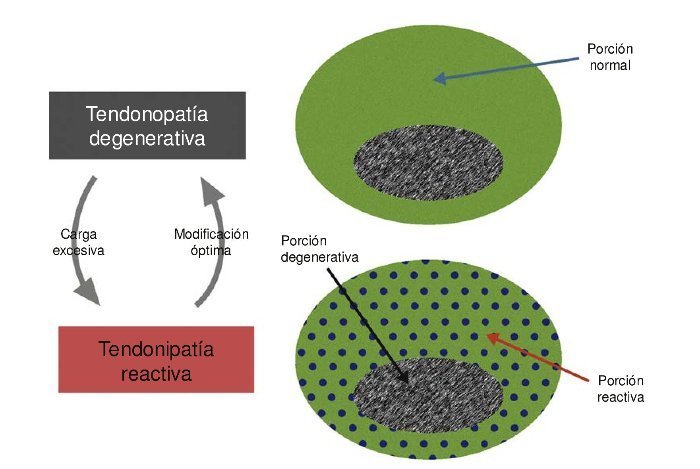
Una vez descritas las diferentes fases del tendón, estas forman parte de un modelo continuo y el tejido podría presentar ejemplos de los tres tipos de tejido al mismo tiempo. Para una mejor comprensión es importante saber que la tendinopatía normalmente solo se presenta con la presencia de dolor y no en su estado asintomático o latente. En el modelo de continuum, el dolor tendinoso se clasifica en dos categorías: a) tendinopatía reactiva en su primera presentación clínica consecuente de una sobrecarga aguda, y b) tendón reactivo (desestructuración tardía) en la fase de patología degenerativa de tendón. Hipotéticamente pensamos que la patología del tendón reactivo está asociada con una expresión nociceptiva, y probablemente debido a un aumento de actividad celular y de la expresión de canales iónicos. En presentaciones de tendón reactivo dentro del proceso degenerativo, es el tejido sano el que se hace reactivo, y no la porción degenerada (fig. 2). En tendones degenerados asintomáticos se dan anormalidades sustanciales en la matriz celular como en la célula, pero -y muy importante- no se da una producción de sustancias nociceptivas o una actividad de señal nociceptiva, ni tampoco en los receptores nociceptivos.
Figura 2 Representación simplificada del estado reactivo en la fase degenerativa de la tendinopatía. Nota: la porción degenerativa del tendón no cambia significativamente. Un ejemplo de esta presentación vista en UTC es presentado por Rudavsky y Cook64.
El origen exacto de los conductores nociceptivos en la tendinopatía sigue siendo desconocido. La fuerte relación entre dolor tendinoso y cargas mecánicas, junto con la incapacidad mecánica de los tenocitos desalineados y la falta de inervación sensitiva del tejido profundo del tendón, podría significar que la célula tendinosa produjese sustancias nociceptivas, como potencial causante nociceptivo27. Estas sustancias, vistas en tendones reactivos o reactivos en fase degenerativa, podrían irritar receptores de nervios periféricos cercanos o al peritendón28. Asimismo, explicarían por qué la patología puede desarrollarse en zonas más profundas del tendón sin presentar dolor tendinoso, ya que estas zonas son más remotas y no les llega inervación. La patología reactiva difusa también puede irritar al peritendón por su aumento de tamaño.
Cargas continuas en un tendón doloroso perpetúan el estímulo nociceptivo, haciendo posible una hiperalgesia secundaria en tendinopatías como respuesta a un estímulo nociceptivo continuo y no a un estado doloroso patofisiológico (sensibilización central)27,29. Numerosas presentaciones clínicas coinciden en el siguiente concepto: el dolor tendinoso permanece localizado y poco relacionado con las carga del tejido30. Habiendo poca evidencia de dolor tendinoso de apariencia espontánea (dolor independiente del estímulo), estos casos suelen ser una característica de estados de dolor patofisiológicos.
El papel del sistema nervioso central en la modulación del dolor está bien descrito por otros autores y no es el propósito de este artículo. Algunos autores consideran la tendinopatía como un dolor centralizado y cuestionan la relevancia de los cambios en la estructura del tendón. Mientras se han evidenciado cambios en la percepción sensorial contralateral en individuos con tendinopatía31, esto podría significar una conducción nociceptiva constante, como si proviniese del tejido local. Los ejercicios isométricos homolaterales a la tendinopatía no han mostrado efecto en el dolor contralateral32, sugiriendo que los factores locales son críticos en la producción del dolor. En resumen, se conoce buena evidencia de las adaptaciones (motoras y sensoriales) de las tendinopatías, aunque todavía no podemos obviar el papel que juegan los nociceptores locales.
Evidencia que apoya este modelo
Como los estudios longitudinales que investigan cambios histopatológicos en humanos son éticamente problemáticos, la evolución y las diferentes fases del modelo del continuum derivan de integrar evidencia de estudios transversales o de prevalencia, estudios por la imagen y estudios con modelos en animales. Curiosamente, los conceptos utilizados en este modelo son estrictamente integrados en los publicados en patología del cartílago articular por Pollard et al33. Estos autores también propusieron el concepto de progresión del tejido cartilaginoso hacia una osteoartritis avanzada. Asimismo, otra similitud ocurre en las respuestas iniciales reversibles de los proteoglicanos y la regulación positiva celular, finalizando en cambios heterogéneos irreversibles del tejido, incluyendo degeneración celular y cartilaginosa.
Estudios histopatológicos
Los estudios realizados en tendones asintomáticos de humanos han demostrado que los cambios de la célula siempre se daban cuando aparecían cambios de la matriz celular20, progresando de cambios leves a la desorganización del colágeno de la matriz y posteriormente -teóricamente, pero no demostrado- a la vascularización. Esto reconocería la progresión de la patología del tendón reactivo al tendón desestructurado. Estudios en animales confirman dichos hallazgos, mostrando una progresión de la patología muy similar17, a pesar de que no están bien considerados para comparar tendinopatías por sobrecargas en humanos.
Estudios por la imagen
En el tendón de Aquiles y por RM se pueden observar las reacciones tendinosas agudas con un aumento del volumen y cambios en la señal después de una sesión de ejercicios34. Dichos cambios coinciden con nuestro modelo, sugiriendo un aumento de volumen (perimétrico) y de agua (directamente de las sustancias sólidas o de vasos) como respuesta a los ejercicios. Estos cambios rápidos han sido confirmados con estudios que investigan la respuesta molecular a la carga19, a pesar de que el conocimiento detrás de la transición de cambios adaptativos a patológicos no se entiende completamente.
El uso de la caracterización del tejido por ultrasonido (UTC) ha demostrado diferentes estados del tejido en el mismo tendón, como se ha mencionado anteriormente24. UTC ha mostrado pequeñas respuestas estructurales en el segundo día después de recibir cargas altas, y estas vuelven a normalizarse al cuarto día en tendones asintomáticos35. Además, se ha visto con UTC una mejoría en los tendones de Aquiles sanos a lo largo de la pretemporada en un equipo de élite en el futbol australiano, reafirmando la capacidad adaptativa sugerida por el modelo de continuum36. Sin embargo, en este mismo grupo, 3 de los 18 participantes presentaron dolor en el tendón de Aquiles, lo que pone de manifiesto la variabilidad del efecto de las cargas dependiente de factores intrínsecos (como genética y adiposidad).
Estudios clínicos
El efecto de la acumulación de cargas en los tendones ha sido claramente demostrado con los tendones sanos de los deportistas. Hace años los deportistas de élite (con historia de mayor carga en los tendones) tenían una mayor incidencia de tendinopatía y rotura que los grupos control por edad37, afirmando así la naturaleza irreversible de la patología degenerativa, ya que los ex deportistas no recuperaban la salud del tendón. Nuestro modelo también está corroborado por investigaciones sobre el impacto de los tratamientos en la estructura del tendón, y muchos estudios han evidenciado que la normalización de la estructura del tendón no necesita mejorías en el dolor y la función38-40, confirmando así la hipótesis de que la adaptación ocurre en la porción alineada y compensadora del tendón, y no en la porción degenerada que permanece mecánicamente en silencio. Además, también lo confirman estudios que demuestran el engrosamiento del tendón de Aquiles, incluso después de varios años de la resolución del dolor41.
Tratamiento de la tendinopatía
La naturaleza del modelo continuum se basa en la gestión, optimización y adaptación de las intervenciones de cada fase de la patología tendinosa. Mientras los ejercicios y el control de las cargas son considerados fundamentales para el tratamiento, existe un exceso de intervenciones intratendinosas y peritendinosas diseñadas para tratar la patología, haciendo más complejo el proceso y la toma de decisiones. Es importante entender que mientras el modelo de continuum presenta tres fases de la patología, dichas fases son continuas y, así, su clasificación no es separativa. Por otro lado, la clasificación de pacientes basándose en la estructura, dolor, disfunción y capacidad de tolerar cargas podría permitir a los profesionales orientar apropiadamente los tratamientos de los factores limitantes críticos.
Tratamientos antiálgicos de las tendinopatías
Los pacientes con tendinopatías requieren consulta médica principalmente por dolor. Existen tratamientos orientados a la disminución del dolor tendinoso, como los antiinflamatorios, las infiltraciones de corticoesteroides42, las ondas de choque43, las inyecciones extratendinosas de volúmenes altos44 y los raspados quirúrgicos45. Mientras que la mayoría de estos tratamientos muestran evidencia en reducir el dolor en corto y medio plazo, la efectividad a largo plazo ha sido cuestionada15; de hecho, se aprecia un efecto mínimo en la capacidad de tolerar cargas31.
La respuesta del tendón ante el papel de los antiinflamatorios es compleja y muy debatida46. Algunos estudios citan niveles normales de mediadores inflamatorios en estados de silencio de la tendinopatía47, mientras otros proponen modelos inflamatorios originando la progresión de la patología48-50.
Actualmente, la evidencia sugiere una mayor presencia de células inflamatorias en tendones dolorosos50. Los anti-inflamatorios han demostrado tener un retraso del proceso de la regeneración del tejido blando, y aunque tengan un efecto en la reducción del dolor, tienen un efecto negativo en el proceso de normalización del tendón51. Los antiinflamatorios suelen prescribirse en tendinopatías reactivas, ya que podrían inhibir la expresión de sustancias clave responsables de esta fase20. Fármacos como el ibuprofeno han demostrado tener un efecto específico en la respuesta reguladora negativa celular52, además del efecto perjudicial en la reparación definitiva del tendón51.
La remisión del dolor es esencial en el tratamiento. Sin embargo, tratamientos dirigidos solamente a la reducción del dolor tienen un efecto mínimo en los factores asociados a la lesión, como alteraciones de la cadena cinética, factores predisponentes a la tendinopatía, o la capacidad del tejido de soportar cargas, consecuentemente aumentando el riesgo de recurrencia de la lesión. Es importante señalar el efecto analgésico inmediato visto con los ejercicios isométricos, así como una reducción de la inhibición cortical del músculo, dándose una mejoría de la fuerza de cuádriceps en tendinopatías rotulianas32. Además, tratamientos con programas de cargas tienen ventajas beneficiosas para el tendón53, para el músculo54 y para el control cortical del músculo, lo que lleva a la mejora en la funcionabilidad y un resultado clínico más óptimo. Un programa de rehabilitación basado en el aumento de cargas es capaz de modificar el equilibrio de excitabilidad e inhibición del control muscular55, cambiando las cargas transmitidas por el tendón.
Otras intervenciones dirigidas a la disminución del dolor incluyen la optimización de las cargas (reducción), permitiendo al tendón que se adapte y a las células que sean menos reactivas. La individualización y la reducción de cargas excesivas son tan sencillas como permitir un día extra de descanso entre sesiones de cargas altas tendinosas, o aconsejar sobre el manejo de las cargas agudas dentro de las cargas internas. También importante, trabajar con cargas tendinosas sin almacenamiento ni liberación de energía (como bicicleta, o fuerza basada en trabajo con pesas), pudiendo continuar, ya que estas no suelen inducir repuesta tendinosa.
Tratamientos dirigidos a la estructura tendinosa
Antiguamente, cambiar la estructura tendinosa era considerado la esencia del tratamiento en las tendinopatías. Sin embargo, cada vez existe más evidencia de la poca relación entre dolor y estructura, mientras que los resultados más positivos se consiguen sin la modificación de la estructura del tendón38. Los tratamientos antiálgicos mencionados anteriormente pueden ser efectivos en reducir la respuesta celular del tendón (disminución de la carga, farmacoterapias), aunque todavía han de ser verificados. Otros tratamientos dirigidos al cambio de la estructura, como cargas excéntricas altas o inyecciones intratendinosas, pueden ser altamente agravantes en una fase de tendón reactivo. La carga también puede ser utilizada para reducir el dolor (isométricos), y también la inhibición motora32, aunque se necesitan más estudios. Esto es importante, ya que hasta ahora los ejercicios con dolor tienen poca aceptación, y la evidencia de ritmos propios de fortalecimiento no restablecen excitabilidad corticoespinal ni la inhibición (p. ej., véase Leung et al.56).
En tendinopatía degenerativa las intervenciones que influyen en la estructura del tendón son menos críticas, ya que la patología parece tener una reversibilidad limitada (los cambios en esta región no son necesarios para un buen resultado). Además, el tendón patológico parece compensar las áreas de desorganización mediante el aumento de las dimensiones para mantener suficiente volumen de las estructuras con fibras alineadas24. Como la mayoría de los tendones degenerativos tienen suficiente tejido capaz de soportar cargas, y dada la limitada capacidad de mejorar en el modelo del continuum, los tratamientos deberían usar estrategias más allá del continuum. Más estudios deberían investigar para intentar entender aquellos tendones que no se adaptan (y por qué). Estos podrían ser los que acaban en roturas tendinosas, que son los más difíciles de estudiar, ya que no presentan clínica hasta su rotura.
Precisamente, los tratamientos deberían proponerse para potenciar más la capacidad de tolerar cargas en las porciones de fibras tendinosas alineadas (resistencia carga/zona con respuesta mecánicamente), que en estimular o reestablecer la porción degenerada. Los ejercicios han demostrado tener efecto en ambos aspectos: estructura y dolor. Los ejercicios excéntricos son los más estudiados y han demostrado ser beneficiosos para el dolor, la funcionabilidad y el retorno a la actividad57.
Mientras que el modelo de continuum clasifica la tendinopatía basándose en la presencia y la cantidad de desorganización estructural, dirigir tratamientos para regenerar las áreas desorganizadas podría ser poco útil, ya que el tendón podría estar ya compensando. La mejor manera de explicar el cambio de concepto sería con la metáfora de tratar un donut (siendo la zona de fibras alineadas) y no el hueco (siendo la zona de fibras desorganizadas). Ocurre que las zonas de fibras alineadas solas no protegen de futuros episodios de tendinopatía reactiva; para evitarlo, los tratamientos deben progresar en el aumento de la capacidad de tolerar cargas en la zona donut a través de programas rehabilitadores de cargas progresivas. Es importante considerar las demandas funcionales del individuo, ya que frecuentemente muchos aspectos de las cargas no son considerados en la rehabilitación. Los ejercicios excéntricos pueden ser un tratamiento efectivo debido a la alta carga que someten al tendón, con el objetivo de mejorar su capacidad de tolerar cargas. Sin embargo, aspectos como cargas en ciclos de estiramiento-acortamiento y trabajo pliométrico no se consideran, pudiendo explicar la insuficiencia de los tratamientos con el manejo de las cargas. Además de incluir el resto de la cadena cinética, se propondría un programa que incorporase 4 fases de rehabilitación (isométricos para reducir dolor, isotónicos para restablecer fuerza, gradualmente introducir ejercicios de almacenamiento de energía, seguido por función específica del deporte/ejercicios de almacenamiento y liberación de energía). Para valorar la efectividad de este tipo de tratamientos se necesita más investigación, a pesar de la dificultad en investigar este tipo de intervenciones individualizadas.
En este contexto es difícil encontrar la importancia de los tratamientos dirigidos a reparar tendones y normalizar su estructura mediante factores de crecimiento (p. ej., PRP)58, los cuales no parecen ser apropiados en el proceso patológico en ninguna de las fases del continuum. Existe ya una respuesta celular tendinosa hiperactiva, y además aumenta el número de células tendinosas en todas las fases, incluso en la fase degenerativa59. El aumento de células añadidas (madres o tenocitos) en ambiente hipercelular parece desacertado, al igual que restablecer una relación matriz-célula viable en una región degenerada del tendón que no es capaz de transmitir tensión.
Tratamientos dirigidos a restablecer funcionalidad y capacidad de carga
Existen pocos artículos que hayan investigado sobre la recuperación de la funcionabilidad en la tendinopatía, ya que se cree que remitir el dolor y restablecer la estructura son de mayor importancia. Clínicamente, se observa a muchos deportistas con dolor, pero estos solo solicitan intervención médica cuando su rendimiento se ve afectado. Es difícil cuantificar funcionalidad y capacidad de carga, cuando medidas puramente de fuerza no reflejan todo lo que ocurre. Se pueden dar alteraciones graduales del reclutamiento muscular asociado con tendinopatía, llevando a cambios en la función32. La vuelta a la práctica deportiva es potencialmente una medida de funcionabilidad, aunque muchos estudios se han llevado a cabo fuera de la temporada competitiva. Mientras que la remisión del dolor elimina una barrera para mejorar la funcionabilidad, otros déficits funcionales -como debilidades musculares, alteraciones en la cadena cinética, incapacidad de tolerar cargas- pueden predisponer al tendón a sufrir recaídas.
Se precisan más estudios para describir mejor los déficits de funcionalidad asociados con las tendinopatías y el desarrollo de herramientas útiles para los terapeutas.
Discusión
El objetivo de este modelo es mejorar la comprensión de las fases en la patología del tendón y asistir a los terapeutas en el razonamiento de objetivos y opciones de tratamiento: manejar el dolor y tratar la disfunción. Sin tener en cuenta el mecanismo inicial, la patología del tendón se caracteriza por una respuesta celular significativa a una lesión13,60. Es improbable que algún modelo pueda describir todos los aspectos de la patoetiología tendinosa, su relación con el dolor y la función, ya que estos procesos y modelos son complejos. La capacidad de testear el modelo del continuum está limitada en parte por la tecnología de diagnósticos por la imagen para detectar cambios estructurales y patológicos, además de necesitar medidas más precisas y de mayor exactitud para cuantificar aspectos del dolor y de la disfunción en las tendinopatías.
Este modelo podría ayudar a la mejoría de las investigaciones en tendinopatía. La variabilidad en las respuestas de los tratamientos podría disminuir, junto a la heterogeneidad de los grupos estudiados y de las diferentes fases implicadas en la patología. Además, muchos tratamientos son invasivos, y sabemos poco de su influencia en la estructura y de la respuesta a cargas o tratamientos. La división en grupos bajo el modelo del continuum podría dar un resultado más claro en los ensayos clínicos, así como mejorar las guías clínicas. Es importante también considerar los factores individuales externos al tendón, como edad, genética, sexo, biomecánica y composición corporal61-63. Se sospecha que dichos factores alteran la progresión o la regresión a lo largo del continuum, y un mayor entendimiento del impacto de estos factores podría mejorar el tratamiento y permitir una mejor asistencia a los deportistas de riesgo.
Conclusiones
El modelo continuum para tendinopatías está basado en las presentaciones clínicas y hallazgos del tendón en la literatura. Se espera que permita mejorar el conocimiento de esta condición compleja, y también mejorar la eficacia de los tratamientos. La investigación biomédica nos recuerda que este artículo, como muchos otros de nuestros compañeros, solo es una parte de un largo y difícil camino para entender mejor esta condición, y requiere valoraciones continuas científicas y clínicas.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Recibido el 10 de abril de 2017;
aceptado el 2 de mayo de 2017
Disponible en Internet el 2 de junio de 2017
∗ Autor para correspondencia.
Correos electrónicos: Silvia.ortega@pl.fcbarcelona.cat, silviaortegacebrian@gmail.com (S. Ortega-Cebrian).