Mals hàbits, com el sedentarisme, l’obesitat o la sobrealimentació, es relacionen amb l’evolució d’estats proinflamatoris crònics, factor principal de risc en el desenvolupament de malalties cròniques no transmissibles (MCNT). Tanmateix, modificar únicament el pes corporal no redueix el risc; també cal augmentar la massa muscular, cosa que fa entendre que hi ha una relació beneficiosa associada a aquest teixit que no està totalment dilucidada. Durant els darrers anys les explicacions cel·lulars més interessants s’han enfocat en la producció de citocines musculars denominades miosines, entre les que destaca la interleucina 6, factor inhibidor de la leucèmia, entre altres estudiades recentment, com ara la mionectina i la musclina. Degut als múltiples avenços, es presenta un revisió que pretén presentar les troballes més recents i representatives sobre les miosines, corregir conceptes i demostrar l’aplicabilitat de la prescripció d’exercici físic per a la salut.
Bad habits such as sedentary lifestyle, obesity or overfeeding, are related to the production of chronic pro–inflammatory states, the main risk factor for the development of chronic noncommunicable diseases (CNCD). However, modifying only the body weight does not reduce the risk, it is necessary to increase muscle mass, this implies there is a beneficial relationship associated with the muscle tissue that is not fully elucidated. During the last years, the most interesting cellular explanations have focused on the production of muscle cytokines called myokines, among which stand out interleukin 6, the inhibitory factor of leukemia, with others recently studied such as mionectine and muscline. Due to the multiple advances, this paper intends to present the most recent and representative findings about myokines, correct concepts and demonstrate their applicability in the prescription of physical exercise for health.
Introducció
Els canvis en l’estil de vida durant els darrers anys involucren àmpliament el sedentarisme, la sobrealimentació, l’obesitat i l’exposició continuada a substàncies tòxiques. Aquests canvis s’associen al desenvolupament d’estats proinflamatoris crònics, fet que constitueix el principal factor de risc per desenvolupar malalties cròniques no transmissibles (MCNT)1. Aquest estat proinflamatori causa citosines produïdes principalment pel sistema immune, el teixit adipós o cèl·lules del sistema immune associades al teixit adipós (especialment macròfags); aquestes citosines actualment són conegudes com a adiposines i els seus receptors s’expressen en múltiples òrgans, contribuint al desenvolupament de les MCNT2.
A més de l’àmplia evidència que relaciona la presència d’adiposines amb les MCNT, actualment és evident que una reducció de la qualitat i quantitat de massa muscular esquelètica és també un factor de risc en el desenvolupament d’MCNT3. Per tant, per mantenir la salut no s’ha de pensar únicament en tenir un pes adequat, sinó que també cal millorar la massa muscular4.
A les darreres dècades, diverses recerques han estudiat la relació entre els resultats existents entre les respostes benèfiques sistèmiques i la contracció muscular generada per l’exercici. Se sap que el múscul esquelètic (ME) genera respostes hipoglucemiants i antioxidants5; això no obstant, les explicacions cel·lulars més interessants s’han enfocat en la producció de citocines musculars amb acció tant endocrina com autoparacrina denominades miosines6.
Des de l’any 2000, quan s’establí que la interleucina 6 (IL–6) era produïda per l’ME com a resposta a la contracció muscular7, s’han realitzat diversos estudis que han permès trobar noves miosines i comprendre’n el paper en el procés de regulació fisiològica de l’exercici físic, tant en persones aparentment sanes com en pacients malalts crònics.
L’any 2012 el nostre grup de treball publicà la revisió «Papel de la producción de miokinas a través del ejercicio»8, que aplegà aleshores les troballes més rellevants sobre el concepte de miosines i la relació amb l’exercici. Degut a diversos avenços sobre el tema, aquesta revisió pretén presentar les troballes més recents i representatives a l’entorn de les miosines, corregir alguns conceptes i demostrar– ne l’aplicabilitat en la prescripció de l’exercici físic per a la salut.
Metodologia
Es realitzà una revisió sistemàtica exploratòria (scoping review) atesa la dificultat per localitzar estudis clínics controlats, seguint les recomanacions de normalització de revisions PRISMA9. S’escolliren articles originals i revisions sistemàtiques que incloguessin el termes de cerca miosines, exercici físic i regulació metabòlica, com a objecte d’estudi, entre gener de 2007 i novembre de 2017, en anglès o en espanyol.
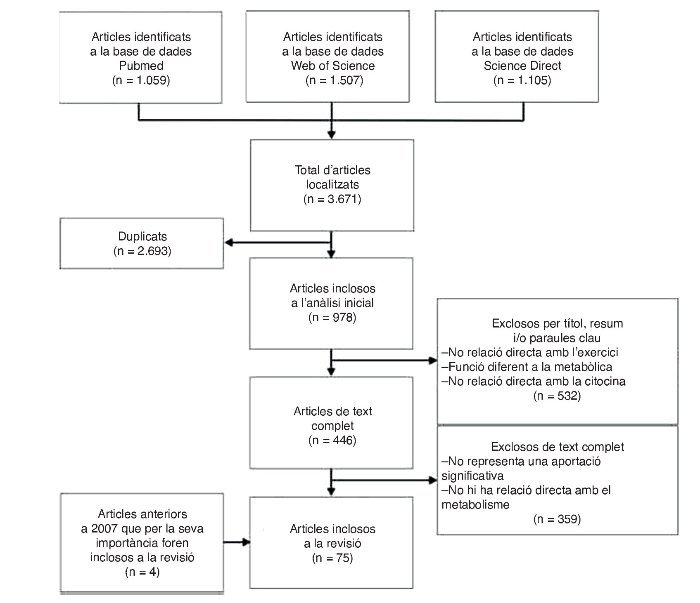
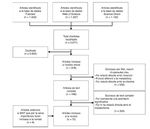
Las bases de dades utilitzades foren: Pubmed, Web of Science, Ovid, Science Direct. La cadena de cerca utilitzà el termes: (Myokines AND exercise), (Interleukin 6 AND exercise), (LIF AND exercise), (Interleukin 15 AND exercise), (BDNF AND exercise), (FGF21 AND exercise). Es localitzaren un total de 3.671 articles, dels quals se’n seleccionaren 75, i s’hi inclogueren 4 articles que per la seva rellevància foren considerats en la revisió. El diagrama de flux de la cerca i la selecció dels articles es representa a la figura 1.
Figura 1. Diagrama de flux de la cerca i selecció d’articles.
Resultats
El múscul esquelètic com a òrgan amb propietats endocrines
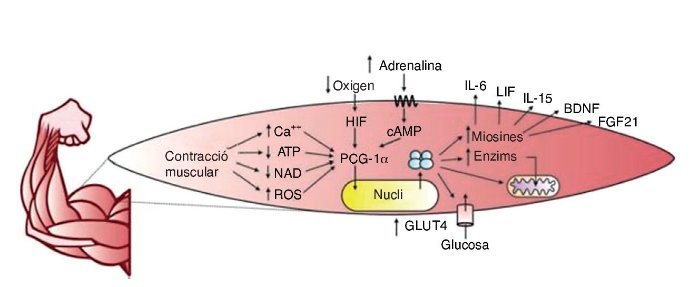
Durant molt de temps es considerà que l’ME era un òrgan encarregat únicament de la locomoció, l’emmagatzemament de proteïnes i la generació de calor. Tanmateix, actualment se sap que l’ME té una alta capacitat d’expressió i repressió de gens a través de senyals intracel·lulars que es presenten especialment durant l’exercici. Entre els segons missatgers identificats hi ha: l’augment de calci intracel·lular, la depleció del trifosfat d’adenosina (ATP), nicotinamida adenina dinucleòtid (NAD) i l’augment d’espècies reactives d’oxigen (ROS); a més de senyals extracel·lulars, com la pressió d’oxigen extracel·lular, senyals endocrins i estímuls mecànics, entre altres10.
El regulador principal de l’activitat gènica, en relació amb l’exercici, està format pel coactivador 1α del receptor activador de la proliferació de peroxisomes gamma (PCG– 1α)11, una proteïna necessària per a la transcripció de gens, que indueix, entre altres funcions, els processos adaptatius de l’ME. Algunes respostes associades al PCG–1α són: l’augment de l’expressió de receptors d’insulina, la captació d’àcids grassos i glucosa, l’emmagatzemament de glucogen i la biogènesi mitocondrial11.
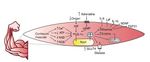
El PCG–1α afavoreix també la síntesi de miosines amb efecte endocrí sobre el propi ME i òrgans com el teixit adipòs12, l’os13, el cervell14, el pàncrees15, l’intestí16 i el teixit adipós marró17, entre altres. El terme «miosines» fou encunyat el 2003 per la Dra. Bente Klarlund Pedersen en el centre d’investigació muscular de Copenhaguen (Dinamarca)18, i mitjançant l’estudi del secretoma muscular s’han trobat centenars de substàncies que s’expressen en resposta a l’exercici19. Un resum gràfic de la producció de miosines mitjançant l’exercici es troba a la figura 2.
Figura 2. ATP: trifosfat d’adenosina; NAD: nicotinamida adenina dinucleòtid; ROS: espècies reactives d’oxigen; HIF: factor induït per hipòxia; cAMP: AMP cíclic; PCG–1α: coactivador 1α del receptor activador de la proliferació de peroxisomes gamma; GLUT4: transportador de glucosa tipus 4; IL–6: interleucina 6; LIF: factor inhibidor de la leucèmia; Il–15: interleucina 15; BDNF: factor neurotròfic derivat del cervell; FGF21: factor de creixement fibroblàstic 21.
A continuació es descriuen les principals troballes més recents entorn de les principals miosines i la seva aplicació potencial, tant en la prescripció de l’exercici físic per a la salut, com en l’entrenament esportiu.
Interleucina 6
L’IL–6 és una proteïna de 212 aminoàcids i un pes dê26 kDa, produïda pel teixit adipós, l’ME i diverses cèl·lules del sistema immune20. Està associada amb l’exercici físic i la seva concentració plasmàtica augmenta diverses vegades després de l’exercici21 com a resultat de la contracció muscular i els canvis en el comportament energètic intracel·lular22.
El receptor de membrana de l’IL–6 (IL–6R) requereix un parell de glucoproteïnes que actuen com a coreceptors (gp130) per formar el complex IL–6–IL6R–gp130 i exercir l’acció intracel·lular. Com que poques cèl·lules expressen l’IL–6R, a diferència del gp130, present en pràcticament totes les poblacions cel·lulars23, l’IL–6 requereix un receptor soluble (sIL–6R)24 per unir–s’hi.
Quan s’utilitzen receptors solubles la senyalització es denomina «trans», i quan s’utilitzen receptors de membrana la senyalització es denomina «clàssica»25, essent la senyalització clàssica antiinflamatòria i la senyalització trans inflamatòria26.
Durant l’exercici físic l’ME produeix IL–6, però no sIL–6R, ja que aquest darrer és produït per un clivatge enzimàtic des d’altres cèl·lules en presència de citocines inflamatòries, com el factor de necrosi tumoral alfa (TNF–α)27. Així, l’IL–6 com a miosina només actua en cèl·lules que expressin IL–6R. En unir–se amb el seu receptor, la senyalització intracel·lular involucra la Janus–cinasa (JAK), que fosforila proteïnes responsables dels senyals de transducció i activadores de la transcripció (STAT), que afavoreixen la transcripció de proteïnes en el nucli28. Les JAK també fosforilen proteïnes cinases activades per AMP (AMPK) i fosfatidil inositol 3 kinasa (PI3K)29, potenciant la captació y la utilització de substrats energètics, l’augment de la sensibilitat a la insulina i l’oxidació d’àcids grassos30. A més, l’IL–6 participa en la hipertròfia i la miogènesi per estímuls generats sobre cèl·lules satèlit31.
A més, l’IL–6 augmenta la lipòlisi i la sensibilitat a la insulina en el teixit adipós32, optimitza la producció d’insulina en el pàncrees33 i en el fetge, i incrementa la glucogenòlisi i la lipòlisi34. També s’ha observat que l’elevació aguda d’IL–6 en el cor limita les lesions cardíaques i té un paper cardioprotector, contrari a l’elevació crònica, que té efectes deleteris35.
L’elevació aguda de la concentració plasmàtica d’IL–6 genera també un efecte antiinflamatori i regula la resposta inflamatòria aguda. Això s’esdevé quan l’alliberament de citocines antiinflamatòries permet l’IL–1 (IL–1ra) i l’IL1040, antagonistes del receptor, i inhibeix la producció del TNF–α36.
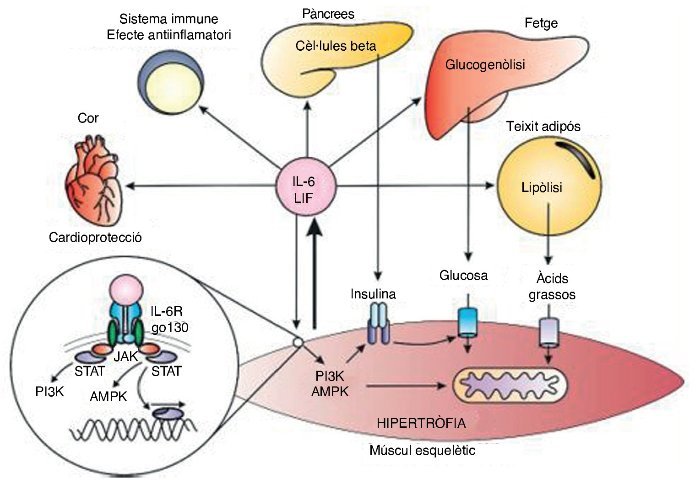
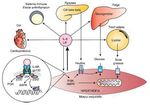
La creixent evidència dels efectes benèfics de l’IL–6 contrasta amb la visió clàssica del seu efecte inflamatori. Durant l’exercici l’IL–6 pot augmentar fins a 100 vegades la concentració basal, essent un augment agut amb una vida mitjana breu, diferent a la inflamació en què l’IL–6 augmenta en companyia d’altres citocines inflamatòries com el TNF–α37 (fig. 3).
Figura 3. Respostes endocrines i autocrines de la interleucina 6 (IL–6) i el factor inhibidor de les leucèmies (LIF). P13K: fosfoinositol 3–cinasa; AMPK: proteïna cinasa activada per AMP; JAK: cinasa JAK; STAT: transducció de senyals i dels activadors de la transcripció.
Factor inhibidor de la leucèmia
El factor inhibidor de la leucèmia (LIF) és una proteïna de 19,7 kDa formada per 181 aminoàcids associada a la diferenciació de cèl·lules mieloides leucèmiques i a l’estímul per formar cèl·lules hematopoiètiques38. L’LIF comparteix el coreceptor gp130 amb l’IL–6, i per tant té una bona part dels seus efectes inflamatoris i antiinflamatoris. En relació a l’exercici, l’LIF s’associa a la hipertròfia del múscul39 i a la hiperplàsia muscular40 degut a l’acció paracrina sobre les cèl·lules satèl·lit. A més, també s’ha suggerit recentment que l’LIF incrementa la captació de glucosa per part de l’ME41 en ratolins (fig. 3).
Interleucina 15
La interleucina 15 (IL–15) és una citocina de 12,9 kDa; descoberta el 1994 en limfòcits T, usualment s’ha relacionat amb processos inflamatoris42. Tanmateix, l’IL–15 també és produïda per l’ME com a resposta a l’exercici (especialment en l’entrenament de força)43, i s’han trobat receptors d’IL– 15 (IL15Rα) a les cèl·lules responsables del control energètic: els rabdomiòcits, els adipòcits i els hepatòcits44.
La senyalització intracel·lular de l’IL–15Rα també està associada al sistema JAK/STAT, la qual cosa explica la similitud que existeix en les respostes metabòliques amb l’IL–6 i l’LIF45. Una expressió major d’IL–15 en l’ME produeix una captació major de glucosa (pel que sembla per l’expressió de receptors GLUT4)46, captació major d’àcids grassos i augment de l’expressió de gens que afavoreix els processos oxidatius47 i genera un efecte antioxidant addicional48. En un principi es presentà l’IL–15 com a activador de la síntesi proteica; tanmateix, l’evidència recent s’ha centrat no sols en la seva acció anabòlica, sinó en l’efecte a nivell de regulació del metabolisme dels rabdomiòcits49.
En el teixit adipós l’IL–15 afavoreix la lipòlisi en produir una activitat mitocondrial major50 i inhibir la diferenciació del preadipòcits51. Hi ha, per tant, una relació inversament proporcional entre la concentració d’IL–15 en el plasma i el teixit adipós, especialment visceral52. En l’adipós marró, l’IL–15 augmenta l’expressió de proteïnes desacobladores, el transport d’àcids grassos i l’efecte termogènic53, cosa que indica que l’IL–15 podria generar canvis interessants en la composició corporal. Això no obstant, els efectes descrits anteriorment són el resultat de l’experimentació amb ratolins, i falta, per tant, estudiar la resposta fisiològica amb éssers humans54.
Recentment, l’IL–15 ha estat descrita com un modulador important del sistema immune amb efecte antiinflamatori, en reduir l’expressió de TNF–α55, amb un potencial efecte beneficiós en malalties com la obesitat i la diabetis mellitus tipus 2 (DM2)56.
Factor neurotròfic derivat del cervell
El factor neurotròfic derivat del cervell (BDNF) és una proteïna d’un pes de 27 kDa que produeix especialment el sistema nerviós central, amb un paper important en el desenvolupament neuronal i en els processos de memòria i aprenentatge57. S’han trobat nivells baixos de BDNF en malalties neurodegeneratives i metabòliques, com obesitat, DM2 i malaltia cardiovascular58.
El BDNF s’uneix a un receptor cinasa B relacionat amb la tropomiosina (TrkB), en què té interacció amb diversos segons missatgers que inclouen el PI3K, que explica en gran mesura les seves funcions metabòliques i mitogèniques59. Actualment el BDNF és considerat una miosina produïda durant l’exercici físic, especialment aeròbic, i en condicions d’estrès energètic60,61.
Per una acció autocrina, el BDNF té un paper important en la regeneració i, probablement, l’adaptació muscular secundària a l’exercici62. Per una acció endocrina, canvis en el BDNF plasmàtic causats per l’exercici físic es relacionen amb efectes de l’escorça cerebral i optimitzen l’execució de funcions mentals superiors, especialment en adults majors63. A més a més, el BDNF genera una oxidació dels greixos major, una disminució de la mida del teixit adipós, una major sensibilitat a la insulina i una reducció de la gana per una interacció directa a nivell hipotalàmic64.
Factor de creixement fibroblàstic 21
El factor de creixement fibroblàstic 21 (FGF–21) pertany a una família de factors de creixement produïts per diverses cèl·lules i amb efectes fisiològics discutibles65. Forma part d’una superfamília de factors de creixement i té un pes molecular que oscil·la entre 17 i 26 kDa64. L’FGF–21 s’uneix a un receptor de membrana (FGFR1) i requereix un cofactor enzimàtic denominat β–Klotho. El complex FGFR1/β–Klotho es troba en el teixit adipós i l’ME, i està relacionat intracellularment amb la fosforilació d’STAT i altres reguladors de l’expressió proteica, com ara les proteïnes cinasa activades per mitògens (MAPK)66.
L’FGF–21 és produït per l’ME durant l’exercici físic67 i produeix una activitat metabòlica muscular incrementada, amb una capacitat oxidativa de glucosa i d’àcids grassos major68, a més d’un efecte antioxidant important69. Això no obstant, el seu efecte com a miosina és controvertit, ja que en condicions de no exercici o fins i tot en diverses patologies és possible trobar–lo augmentat.
Altres miosines amb efecte metabòlic
Actualment hi ha altres miosines que són objecte d’investigació pel seu potencial efecte metabòlic. La mionectina, que relaciona l’exercici amb el metabòlic d’àcids grassos70; la fibronectina tipus III (irisina), que té un potencial efecte en la formació del greix beix a partir del greix blanc71; l’àcid beta–aminoisobutíric (BAIBA), que és capaç de reduir el teixit adipós72; la proteïna secretada àcida i rica en cisteïna (SPARC o osteonectina), que té efecte en el metabolisme dels carbohidrats73, i la musclina, que indueix biogènesi mitocondrial74.
Discussió
Miosines, entrenament i salut
Per tal de garantir una aportació contínua i suficient de substrats amb què reemplaçar les reserves energètiques i assegurar la reparació tissular, l’ME genera miosines que afavoreixen la hidròlisi de triglicèrids en el teixit adipós i una major captació d’àcids grassos per part de l’ME, entre els quals hi ha IL–6, IL–15, BDNF, FGF–21 i BAIBA. Al seu torn, aquestes miosines generen una reducció de la mida dels adipòcits (especialment viscerals), la qual cosa té un efecte interessant en relació amb els efectes de l’exercici físic en les malalties com l’obesitat75.
Com que l’ME també utilitza carbohidrats durant l’exercici, algunes miosines (IL–6, LIF, IL–15, FGF–21, FNDC5, SPARC) també afavoreixen l’expressió de GLUT4 en l’ME a través de mecanismes independents de la insulina, la qual cosa redueix les concentracions plasmàtiques de glucosa durant l’exercici i fins a les 24 h posteriors. Aquests efectes reforcen l’impacte, ja ben conegut, de l’exercici físic sobre la prevenció i el maneig de diverses formes de diabetis mellitus75.
Donat que la inflamació, com l’exercici, requereix de substrats metabòlics, és possible entendre com diverses miosines estan relacionades amb el sistema immune i estan involucrades en processos inflamatoris.
Consideracions finals
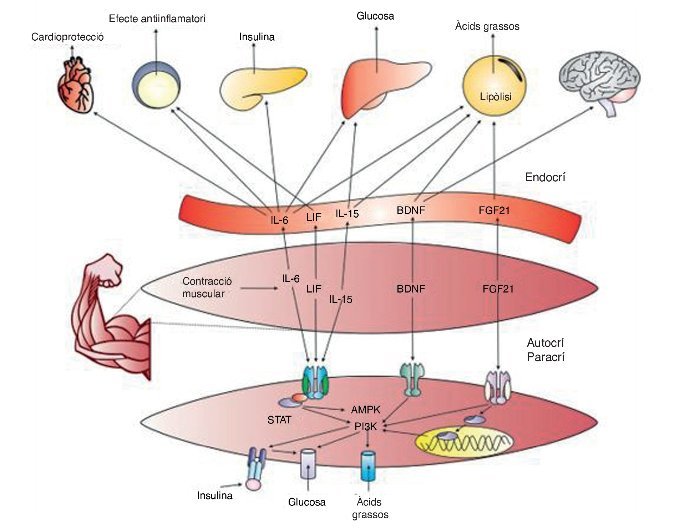
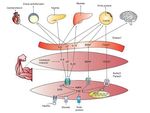
Fins ara les troballes relacionades amb la comprensió de les miosines han permès iniciar un camp d’investigació prometedor sobre la comunicació química entre el múscul i altres òrgans, cosa que ha de permetre el desenvolupament de fàrmacs que actuïn com a agonistes dels efectes beneficiosos de l’exercici, i probablement encara és més important, la recerca sobre la optimització i individualització de programes d’entrenament i exercici físic per a la salut. La figura 4 conté un resum general de les miosines i els seus efectes sobre el cos.
Figura 4. IL–6: interleucina 6; LIF: factor inhibidor de leucèmies; Il–15: interleucina 15; PI3K: fosfatidil inositol 3–cinasa; BDNG: factor neurotròfic derivat del cervell; FGF21: factor de creixement fibroblàstic 21; AMPK: proteïna cinasa activada per AMP; STAT: transducció de senyals i dels activadors de la transcripció.
Conflicte d’interessos
Els autors declaren que no tenen cap conflicte d’interessos.
Agraïments
Al grup de recerca en processament de senyals biològics en medicina (PROSEIM) i a la Facultat de Medicina de la Universitat de La Sabana pel seu suport al llarg del temps al desenvolupament d’aquesta revisió.
Rebut el 26 de febrer de 2018;
acceptat el 4 de setembre de 2018
* Autor per a la correspondència.
Correu electrònic:daniel.botero@unisabana.edu.co (D.A. Botero–Rosas).