Malos hábitos como el sedentarismo, la obesidad o la sobrealimentación se relacionan con la evolución de estados pro-inflamatorios crónicos, principal factor de riesgo para el desarrollo de enfermedades crónicas no transmisibles (ECNT). Sin embargo, modificar únicamente el peso corporal no reduce el riesgo; es necesario también aumentar la masa muscular, dando a entender que existe una relación benéfica asociada a este tejido que no está totalmente dilucidada. Durante los últimos años las explicaciones celulares más interesantes se han centrado en la producción de citocinas musculares denominadas miocinas, dentro de las que destacan la interleucina 6, el factor inhibidor de la leucemia, entre otras recientemente estudiadas como la mionectina y la musclina. Debido a los múltiples avances, se realiza una revisión que pretende presentar los hallazgos más recientes y representativos acerca de las miocinas, corregir conceptos y demostrar su aplicabilidad en la prescripción del ejercicio físico para la salud.
Bad habits such as sedentary lifestyle, obesity or overfeeding, are related to the production of chronic pro-inflammatory states, the main risk factor for the development of chronic noncommunicable diseases (CNCD). However, modifying only the body weight does not reduce the risk, it is necessary to increase muscle mass, this implies there is a beneficial relationship associated with the muscle tissue that is not fully elucidated. During the last years, the most interesting cellular explanations have focused on the production of muscle cytokines called myokines, among which stand out interleukin 6, the inhibitory factor of leukemia, with others recently studied such as mionectine and muscline. Due to the multiple advances, this paper intends to present the most recent and representative findings about myokines, correct concepts and demonstrate their applicability in the prescription of physical exercise for health.
Introducción
Los cambios en el estilo de vida durante los últimos años involucran ampliamente el sedentarismo, la sobrealimentación, la obesidad y la exposición continua a sustancias tóxicas. Estos cambios se asocian al desarrollo de estados proinflamatorios crónicos, constituyendo el principal factor de riesgo para el desarrollo de enfermedades crónicas no transmisibles (ECNT)1. Este estado pro-inflamatorio se acompaña de citocinas producidas principalmente por el sistema inmune, el tejido adiposo o células del sistema inmune asociadas al tejido adiposo (especialmente macrófagos); estas citocinas se conocen en la actualidad como adipocinas y sus receptores se expresan en múltiples órganos, contribuyendo al desarrollo de las ECNT2.
Además de la amplia evidencia que relaciona la presencia de adipocinas con las ECNT, en la actualidad es claro que una reducción de la calidad y la cantidad de masa muscular esquelética es también un factor de riesgo en el desarrollo de ECNT3. Por tanto, para mantener la salud no solo se debe pensar en tener un peso adecuado, sino que es necesario mejorar la masa muscular4.
En las últimas décadas, múltiples investigaciones han estudiado la relación que existe entre las respuestas benéficas sistémicas y la contracción muscular generada por el ejercicio; se sabe que el músculo esquelético (ME) genera respuestas hipoglucemiantes y antioxidantes5; sin embargo, las explicaciones celulares más interesantes se han enfocado en la producción de citocinas musculares con acción tanto endocrina como autoparacrina denominadas miocinas6.
Desde el año 2000, cuando se encontró que la interleucina 6 (IL-6) era producida por el ME como respuesta a la contracción muscular7, se han realizado diversos estudios que han permitido descubrir nuevas miocinas y entender el papel de estas en el proceso de regulación fisiológica del ejercicio físico, tanto en personas aparentemente sanas como en pacientes crónicamente enfermos.
En el año 2012 nuestro grupo de trabajo publicó la revisión «Papel de la producción de miokinas a través del ejercicio»8, donde se reunieron, en su momento, los hallazgos más relevantes sobre el concepto de miocinas y su relación con el ejercicio. Debido a los múltiples avances respecto al tema, esta revisión pretende presentar los hallazgos más recientes y representativos en torno a las miocinas, corregir algunos conceptos y demostrar su aplicabilidad en la prescripción del ejercicio físico para la salud.
Metodología
Se realizó una revisión sistémica exploratoria (scoping review) dada la dificultad para ubicar estudios clínicos controlados, siguiendo las recomendaciones de estandarización de revisiones PRISMA9. Se eligieron artículos originales y revisiones sistemáticas que incluyeran los términos de búsqueda miocinas, ejercicio físico y regulación metabólica como objeto de estudio, entre enero de 2007 y noviembre de 2017 en inglés o en español.
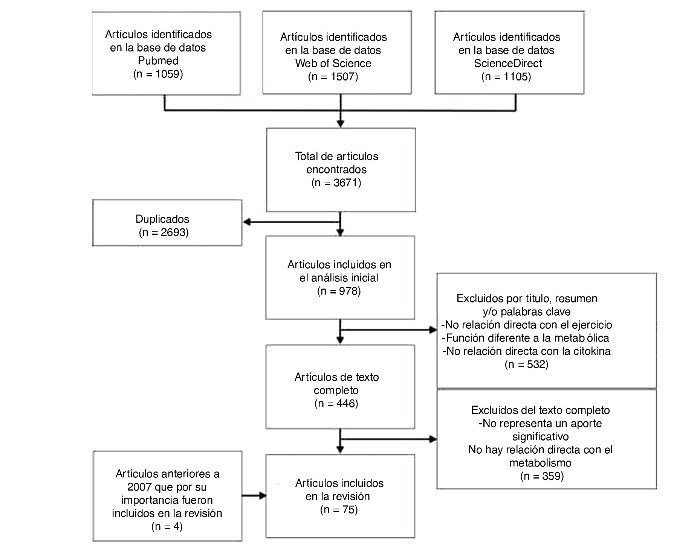
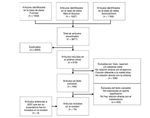
Las bases de datos utilizadas fueron: Pubmed, Web of Science, Ovid, Science Direct. La cadena de búsqueda utilizó los términos: (Myokines AND exercise), (Interleukin 6 AND exercise), (LIF AND exercise), (Interleukin 15 AND exercise), (BDNF AND exercise), (FGF21 AND exercise). En total se encontraron 3.671 artículos, de los cuales se seleccionaron 75 artículos, incluyéndose 4 artículos que por su relevancia fueron considerados en la revisión. El flujograma de la búsqueda y selección de los artículos se encuentra en la figura 1.
Figura 1. Diagrama de flujo de la búsqueda y selección de artículos.
Resultados
El músculo esquelético como órgano con propiedades endocrinas
El ME fue considerado durante mucho tiempo como un órgano encargado únicamente de la locomoción, el almacenamiento de proteínas y la generación de calor. Sin embargo, en la actualidad se sabe que el ME tiene una alta capacidad de expresión y represión de genes dada por señales intracelulares que se presentan especialmente en el ejercicio. Dentro de los segundos mensajeros identificados están el aumento del calcio intracelular, la depleción del adenosin trifosfato (ATP), nicotinamida adenina dinucleótido (NAD) y el aumento de especies reactivas de oxígeno (ROS); además de señales extracelulares como: la presión de oxígeno extracelular, señales endocrinas y estímulos mecánicos, entre otros10.
El principal regulador de la actividad génica, en relación con el ejercicio, está constituido por el coactivador 1α del receptor activador de la proliferación de peroxisomas gamma (PCG-1α)11, una proteína necesaria para la transcripción de genes que induce, entre otras funciones, los procesos adaptativos del ME. Algunas respuestas asociadas al PCG-1α son: el aumento de la expresión de receptores de insulina, la captación de ácidos grasos y glucosa, el almacenamiento de glucógeno y la biogénesis mitocondrial11.
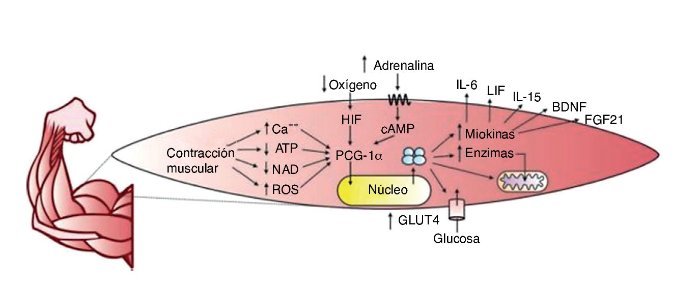
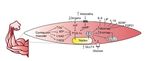
El PCG-1α favorece también la síntesis de miocinas con efecto endocrino sobre el mismo ME y órganos como el tejido adiposo12, el hueso13, el cerebro14, el páncreas15, el intestino16 y la grasa parda17, entre otros. El término miocinas fue acuñado en 2003 por la Dra. Bente Klarlund Pedersen en el centro de investigación muscular en Copenhague (Dinamarca)18, y mediante el estudio del secretoma muscular se han encontrado cientos de sustancias que se expresan en respuesta al ejercicio19. Un resumen gráfico de la producción de miocinas por el ejercicio se encuentra en la figura 2.
Figura 2. ATP: adenosín trifosfato; NAD: nicotinamida adenina dinucleótido; ROS: especies reactivas de oxígeno; HIF: factor inducido por hipoxia; cAMP: AMP cíclico; PCG-1α: coactivador 1α del receptor activador de la proliferación de peroxisomas gamma; GLUT4: transportador de glucosa tipo 4; IL-6: interleucina 6; LIF: factor inhibidor de la leucemia; Il-15: interleucina 15; BDNF: factor neurotrófico derivado del cerebro; FGF21: factor de crecimiento fibroblástico 21.
A continuación se describen los hallazgos más recientes en torno de las principales miocinas y su potencial aplicación, tanto en prescripción del ejercicio físico para la salud, como en entrenamiento deportivo.
Interleucina 6
La IL-6 es una proteína de 212 aminoácidos y un peso de ~26 kDa, producida por el tejido adiposo, el ME y diversas células del sistema inmune20. Tiene asociación con el ejercicio físico y su concentración plasmática aumenta varias veces posterior a este21 como resultado de la contracción muscular y los cambios en el comportamiento energético intracelular22.
El receptor de membrana de la IL-6 (IL-6R) requiere una pareja de glucoproteínas que actúan como co-receptores (gp130) para formar el complejo IL-6-IL6R-gp130 y ejercer su acción intracelular. Dado que pocas células expresan el IL-6R, a diferencia del gp130, presente en prácticamente todas las poblaciones celulares23, la IL-6 requiere un receptor soluble (sIL-6R)24 para unirse a todas estas.
Al utilizar receptores solubles la señalización se denomina «trans», y al utilizar receptores de membrana la señalización se denomina «clásica»25; la señalización clásica es antiinflamatoria y la señalización trans, inflamatoria26.
Durante el ejercicio físico el ME produce IL-6, pero no sIL-6R, ya que este último es producido por un clivaje enzimático desde otras células en presencia de citocinas inflamatorias como el factor de necrosis tumoral alfa (TNF-α)27. De esta forma, la IL-6 como miocina solo actúa en células que expresen IL-6R. Al unirse a su receptor, la señalización intracelular involucra Janus cinasas (JAK), que fosforilan proteínas responsables de las señales de transducción y activadoras de la transcripción (STAT), que en el núcleo favorecen la transcripción de proteínas28. Las JAK también fosforilan proteíncinasas activadas por AMP (AMPK) y fosfatidil inositol 3 cinasa (PI3K)29, potenciando la captación y la utilización de sustratos energéticos, el aumento de la sensibilidad a la insulina y la oxidación de ácidos grasos30. Además de esto, la IL-6 participa en la hipertrofia y la miogénesis por estímulos generados sobre células satélite31.
Además, la IL-6 aumenta la lipólisis y la sensibilidad a la insulina en el tejido adiposo32, optimiza la producción de insulina en el páncreas33, y en el hígado incrementa la glucogenólisis y lipólisis34. También se ha encontrado que la elevación aguda de IL-6 en el corazón limita las lesiones cardiacas y tiene un papel cardioprotector, contrario a la elevación crónica, que tiene efectos deletéreos35.
La elevación aguda de la concentración plasmática de IL-6 genera también un efecto antiinflamatorio y regula la respuesta inflamatoria aguda. Esto se presenta cuando la liberación de citocinas antiinflamatorias permite la IL-1 (IL-1ra) y la IL1040, antagonistas del receptor, e inhibe la producción de TNF-α36.
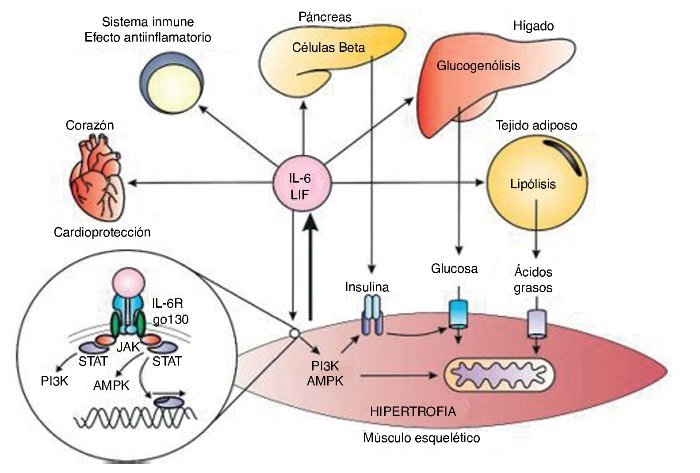
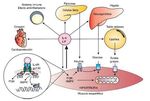
La creciente evidencia de los efectos benéficos de la IL-6 contrasta con la visión clásica de su efecto inflamatorio. Durante el ejercicio la IL-6 puede aumentar hasta 100 veces su concentración basal, siendo un aumento agudo con vida media corta, diferente a la inflamación, donde la IL-6 aumenta en compañía de otras citocinas inflamatorias como el TNF-α37 (fig. 3).
Figura 3. Respuestas endocrinas y autocrinas de la interleucina 6 (IL-6) y el factor inhibidor de la leucemia (LIF). P13K: fosfatidil inositol 3 cinasa; AMPK: proteína cinasa activada por AMP; JAK: cinasa JAK; STAT: transducción de señales y de los activadores de la transcripción.
Factor inhibidor de la leucemia
El factor inhibidor de la leucemia (LIF) es una proteína de 19,7 kDa formada por 181 aminoácidos asociada a la diferenciación de células mieloides leucémicas y al estímulo para la formación de células hematopoyéticas38. El LIF comparte el co-receptor gp130 con la IL-6, por lo que tiene buena parte de los efectos inflamatorios y antiinflamatorios. En relación con el ejercicio, el LIF se asocia a hipertrofia muscular39, y por acción paracrina sobre las células satélite, a hiperplasia muscular40. Además, se ha planteado recientemente que el LIF incrementa la captación de glucosa por parte del ME41 en ratones (fig. 3).
Interleucina 15
La interleucina 15 (IL-15) es una citocina de 12,9 kDa; descubierta en 1994 en linfocitos T, usualmente se ha relacionado con procesos inflamatorios42. Sin embargo, la IL-15 también es producida por el ME en respuesta al ejercicio (especialmente en entrenamiento de fuerza)43, encontrando receptores de IL-15 (IL15Rα) en las células responsables del control energético: los rabdomiocitos, los adipocitos y los hepatocitos44.
La señalización intracelular del IL15Rα también se encuentra asociada al sistema JAK/STAT, lo cual explica la similitud que existe en las respuestas metabólicas con la IL-6 y el LIF45. Una mayor expresión de IL-15 en el ME lleva a una mayor captación de glucosa (al parecer por la expresión de receptores GLUT4)46, mayor captación de ácidos grasos y aumento de la expresión de genes que favorecen los procesos oxidativos47 generando un efecto antioxidante adicional48. En un principio se expuso la IL-15 como activador de la síntesis proteica; sin embargo, la evidencia reciente se ha centrado no solo en su acción anabólica, sino en su efecto a nivel de la regulación del metabolismo de los rabdomiocitos49.
En el tejido adiposo la IL-15 favorece la lipólisis al producir una mayor actividad mitocondrial50 e inhibir la diferenciación de los preadipocitos51. Se da así una relación inversamente proporcional entre la concentración de IL-15 en plasma y el tejido adiposo, especialmente visceral52. En la grasa parda, la IL-15 aumenta la expresión de proteínas desacopladoras, el trasporte de ácidos grasos y el efecto termogénico53, lo que indica que la IL-15 podría generar cambios interesantes en la composición corporal. Sin embargo, los efectos descritos anteriormente son resultados de experimentación en ratones, y falta estudiar las respuestas fisiológicas en humanos54.
Recientemente, la IL-15 ha sido descrita como un importante modulador del sistema inmune con efecto antiinflamatorio, al reducir la expresión del TNF-α55, con potencial efecto benéfico en enfermedades como la obesidad y la diabetes mellitus tipo 2 (DM2)56.
Factor neurotrófico derivado del cerebro
El factor neurotrófico derivado del cerebro (BDNF) es una proteína con un peso de 27 kDa, producida especialmente por el sistema nervioso central, con un importante papel en el desarrollo neuronal y en los procesos de memoria y aprendizaje57. Se han encontrado niveles bajos de BDNF en enfermedades neurodegenerativas y metabólicas como obesidad, DM2 y enfermedad cardiovascular58.
El BDNF se une a un receptor quinasa B relacionado con la tropomiosina (TrkB), donde interacciona con diversos segundos mensajeros incluyendo el PI3K, que explica en gran medida sus funciones metabólicas y mitogénicas59. En la actualidad el BDNF es considerado una miocina producida durante el ejercicio físico especialmente aeróbico y en condiciones de estrés energético60,61.
Por acción autocrina, el BDNF tiene un papel importante en la regeneración y, probablemente, en la adaptación muscular secundaria al ejercicio62. Por acción endocrina, cambios en el BDNF plasmático causados por el ejercicio físico se relacionan con efectos en la corteza cerebral, optimizando la ejecución de funciones mentales superiores, especialmente en adultos mayores63. Adicionalmente, el BDNF genera mayor oxidación de grasas, disminución en el tamaño del tejido adiposo, mayor sensibilidad a la insulina y una reducción del apetito por interacción directa a nivel hipotalámico64.
Factor de crecimiento fibroblástico 21
El factor de crecimiento fibroblástico 21 (FGF-21) pertenece a una familia de factores de crecimiento producidos por varias células y con efectos fisiológicos controvertidos65. Forma parte de una superfamilia de factores de crecimiento y su peso molecular oscila entre 17 y 26 kDa64. El FGF-21 se une a un receptor de membrana (FGFR1) y requiere un cofactor enzimático denominado β-Klotho. El complejo FGFR1/β-Klotho se encuentra en el tejido adiposo y el ME, y está relacionado intracelularmente con la fosforilación de STAT y otros reguladores de la expresión proteica, como las proteíncinasas activadas por mitógenos (MAPK)66.
El FGF-21 es producido por el ME durante el ejercicio físico67 y lleva a una actividad metabólica muscular incrementada, con mayor capacidad oxidativa de glucosa y ácidos grasos68, además de un importante efecto antioxidante69. Sin embargo, su efecto como miocina es controvertido, ya que, en condiciones de no ejercicio e incluso en múltiples patologías, es posible encontrarlo aumentado.
Otras miocinas con efecto metabólico
En la actualidad existen otras miocinas que son objeto de investigación por su potencial efecto metabólico: la mionectina, que relaciona el ejercicio con el metabolismo de ácidos grasos70; la fibronectina tipo III (irisina), que tiene un potencial efecto en la formación de grasa beige a partir de grasa blanca71; el ácido beta-aminoisobutírico (BAIBA), capaz de reducir el tejido adiposo72; la proteína secretada ácida y rica en cisteína (SPARC u osteonectina), que tiene efecto en el metabolismo de los hidratos de carbono73, y la musclina, que induce biogénesis mitocondrial74.
Discusión
Miocinas, entrenamiento y salud
Para garantizar un aporte continuo y suficiente de sustratos con los cuales reponer las reservas energéticas y asegurar la reparación tisular, el ME genera miocinas que favorecen la hidrólisis de triglicéridos en el tejido adiposo y una mayor captación de ácidos grasos por parte del ME, entre las que se encuentran la IL-6, la IL-15, el BDNF, el FGF-21 y el BAIBA. Estas, a su vez, generan una reducción del tamaño de los adipocitos (especialmente viscerales), lo que tiene un efecto interesante en relación con los efectos del ejercicio físico sobre enfermedades como la obesidad75.
Dado que el ME también utiliza hidratos de carbono durante el ejercicio, algunas miocinas (IL-6, LIF, IL-15, FGF-21, FNDC5, SPARC) también favorecen la expresión de GLUT4 en el ME por mecanismos independientes de la insulina, lo que reduce las concentraciones plasmáticas de glucosa durante el ejercicio y hasta 24 h posterior a este. Estos efectos refuerzan el impacto, ya bien conocido, que tiene el ejercicio físico sobre la prevención y el manejo de las diversas formas de diabetes mellitus75.
Dado que la inflamación, al igual que el ejercicio, requiere sustratos metabólicos, es posible entender cómo varias de la miocinas tienen relación con el sistema inmune y están involucradas en procesos inflamatorios.
Consideraciones finales
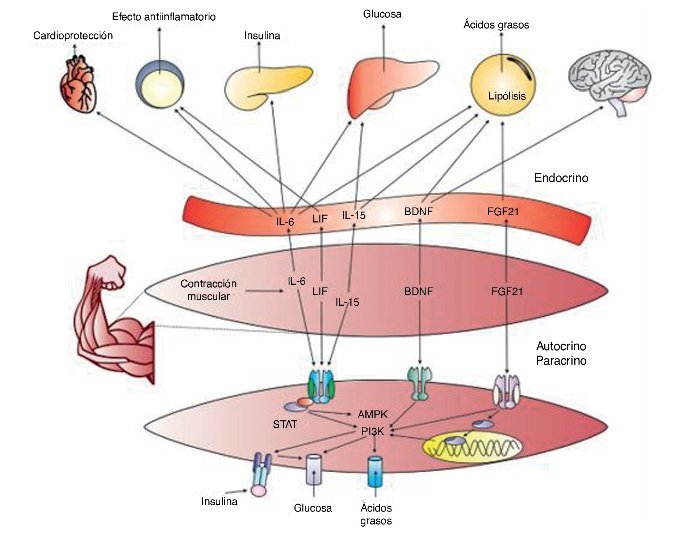
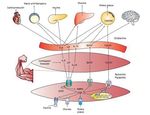
Los hallazgos generados hasta el momento en la comprensión de las miocinas permiten abrir un promisorio campo de investigación en torno de la comunicación química entre el músculo y otros órganos, lo que permitirá: el desarrollo de fármacos que actúen como agonistas de los efectos benéficos del ejercicio, siendo probablemente más importante aún la investigación en torno de la optimización e individualización de programas de entrenamiento y ejercicio físico para la salud. Un resumen general de las miocinas descritas y sus efectos en el cuerpo puede verse en la figura 4.
Figura 4. IL-6: interleucina 6; LIF: factor inhibidor de la leucemia; Il-15: interleucina 15; PI3K: fosfatidil inositol 3 cinasa; BDNG: factor neurotrófico derivado del cerebro; FGF21: factor de crecimiento fibroblástico 21; AMPK: proteína cinasa activada per AMP; STAT: transducción de señales y de los activadores de la transcripción.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
Agradecimientos
Al grupo de investigación en procesamiento de señales biológicas en medicina (PROSEIM) y a la facultad de Medicina de la Universidad de La Sabana por el apoyo en tiempo para el desarrollo de esta revisión.
Recibido el 26 de febrero de 2018;
aceptado el 4 de septiembre de 2018
* Autor para correspondencia.
Correo electrónico:daniel.botero@unisabana.edu.co (D.A. Botero-Rosas).