Introducción: El objetivo de este estudio fue determinar los efectos de un programa combinado de ejercicios de fuerza y aeróbicos de alta intensidad sobre la calidad de vida, la fatiga, el consumo máximo de oxígeno, la fuerza y el IGF-I en personas supervivientes al cáncer de mama (SCM) que habían sido sometidas a cirugía, quimioterapia y/o radioterapia y tratadas con tamoxifeno.
Métodos: Ocho SCM siguieron un programa de ejercicios, 3 veces por semana durante un período de 22 semanas, con una intensidad del 80%. Se evaluaron la reserva del ritmo cardíaco (RRC), la fuerza, la calidad de vida (CV), la fatiga y el factor de crecimiento insulínico tipo 1 (IGF-I).
Resultados: Las 8 participantes reflejaron un índice de adherencia del 97,8% al programa de entrenamiento. Se observaron el incremento de consumo máximo de oxígeno (20%), el incremento de fuerza (56,9%) en el brazo sin linfadenectomía y el incremento de fuerza (104%) en el brazo con linfadenectomía. Se produjo una mejora de la calidad de vida (24%) de acuerdo con las escalas SF36 y FACT-B. Disminuyeron la fatiga general y el desánimo (67,7%), al igual que los niveles plasmáticos del IGF-I (22,8%).
Conclusiones: Un programa en el que se incremente la fuerza y el ejercicio aeróbico al 80% de la RRC puede resultar eficaz para mejorar la CV, el consumo máximo de oxígeno y la fuerza, y disminuir la fatiga y los niveles plasmáticos de IGF-I, en personas supervivientes al cáncer de mama, no generando ni exacerbando el linfedema.
Introduction: The purpose of this study was to determine the effects of a combined strength and high-intensity aerobic exercise program on the quality of life (QOL), fatigue, peak oxygen consumption, strength and IGF-I in breast cancer survivors (BCSs) who had undergone surgery, chemotherapy and/or radiation therapy and were being treated with tamoxifen.
Methods: Eight BCSs followed the exercise program three times per week for 22 weeks at an intensity of 80%. Heart rate reserve (HRR), strength, QOL, fatigue and insulin-like growth factor-I were evaluated.
Results: The eight participants had a 97.8% adherence rate to the training program. Increased peak oxygen consumption (20%), increased strength (56.9%) in the arm without lymphadenectomy (AWL), and increased strength (104%) in the lymphadenectomy arm (AL) were observed. QOL was improved (24%) according to the SF36 and the FACT-B scales. Both general and mood fatigue decreased (67.7%), as did the plasma IGF-I levels (22.8%).
Conclusions: A program of incremental strength and aerobic exercise at 80% of the HRR may be effective in improving QOL, maximum oxygen consumption, and strength and in decreasing fatigue and plasma levels of IGF-I in BCSs and does not generate or exacerbate lymphedema.
Introducción
El cáncer de mama es una neoplasia que requiere un tratamiento intenso y prolongado con tratamientos coadyuvantes, generando varios efectos psicológicos y fisiológicos. Estos efectos afectan negativamente a la calidad de vida (CV) de las personas supervivientes al cáncer de mama (SCM) y pueden durar muchos años.
La severidad y la duración de los síntomas dependen del tipo de tratamiento. Los efectos de la radioterapia, la quimioterapia y la cirugía no se limitan a las células tumorales. Estos tratamientos dañan tejidos sanos, y sus efectos se han correlacionado con la fatiga, la somnolencia, la ansiedad y el estrés emocional en SCM. Se ha estimado que la fatiga afecta al 96% de las pacientes que reciben tratamiento de quimioterapia y del 78-100% de las que han sido objeto de radioterapia1. Aproximadamente el 48% de estas pacientes presentan síntomas de depresión y ansiedad2. Varios estudios han mostrado que la radioterapia puede estar implicada en la fibrosis intersticial de miocardio y la aterosclerosis de las arterias coronarias y carótidas3. La quimioterapia y la radioterapia pueden asociarse a trastornos de la función ventricular izquierda, debido a alteraciones en la morfología ventricular, a una relación anormal entre la presión y el volumen, y a una disminución de la fracción de eyección ventricular izquierda3. Además, la cirugía puede estar acompañada de disección axilar, que, junto con la radioterapia, lleva a un mayor riesgo de desarrollo de linfedema.
Se han demostrado los efectos del factor de crecimiento similar a la insulina (IGF) en la estimulación de la proliferación celular, la mitosis y la apoptosis, y pueden inducir a la transformación de células normales en células cancerosas y promover el desarrollo de tumores3. Los experimentos en ratones transgénicos han demostrado que la sobreexpresión de IGF-I conduce a mayores tasas de tumores mamarios4. Unos niveles elevados de plasma de IGF-I se asocian a un aumento de la densidad mamográfica y a tumores que conllevan a mutaciones BRCA1.
Estudios epidemiológicos, revisiones sistemáticas y metaanálisis de ensayos aleatorizados controlados han revelado una asociación directa entre los niveles plasmáticos de IGF-I y el riesgo de cáncer de mama5, sugiriendo que las mujeres con altos niveles de IGF-I o niveles plasmáticos bajos de IGFBP-3 tienen riesgos relativos más elevados (1,5-1,6 veces) de desarrollar un cáncer de mama, en comparación con las mujeres con niveles más bajos. Las mujeres premenopáusicas con niveles IGF-I en el cuartil más alto pueden tener el doble de riesgo de desarrollar cáncer de mama que las del cuartil más bajo. Por el contrario, unos bajos niveles de IGF-I se asocian con un riesgo menor de cáncer6. Varios estudios han demostrado la relación entre altas concentraciones de IGF-I y el riesgo de recidiva y muerte en SCM7.
Existe en la actualidad una amplia evidencia epidemiológica y experimental sobre el papel desarrollado por la actividad física en la rehabilitación de SCM. Metaanálisis y revisiones sistemáticas de ensayos clínicos aleatorizados han confirmado los efectos positivos del ejercicio físico sobre la función biológica y cardiopulmonar y la reducción de las hormonas sexuales, la masa corporal grasa, la insulina, la IGF, las adipocitoquinas y la densidad mamográfica, así como el aumento de la función inmune y la mejora de los sistemas de defensa antioxidante y CV en SCM8,9.
Estudios realizados en ratones10 y en humanos han demostrado que el ejercicio físico durante y después de las sesiones de quimioterapia protege el sistema cardiovascular de los agentes cardiotóxicos contenidos en los agentes quimioterapéuticos (p. ej., ciclofosfamida, metotrexato, 5-fluorouracilo, medicamentos a base de antraciclina y taxanos) mediante el aumento de la síntesis de óxido nítrico endotelial y la atenuación de la peroxidación lipídica inducida por la quimioterapia en el miocardio.
El ejercicio físico puede disminuir la insulinorresistencia del hígado y de los tejidos, y aumentar el metabolismo de la glucosa a través de diversos mecanismos, tales como un aumento de la vía de señalización de la insulina postreceptor. Esta resistencia insulínica reducida puede disminuir los niveles circulantes de insulina, que a su vez pueden reducir la biodisponibilidad de IGF, a través de cambios de insulina mediada en los niveles de IGFBP11.
Además, el ejercicio físico ha sido asociado a un aumento de la esperanza de vida y a una disminución de los riesgos de recidiva del cáncer y desarrollo de linfedema12. La evidencia científica es sólida y abundante acerca del efecto positivo del ejercicio físico sobre la CV y la fatiga de mujeres con cáncer de mama13.
A pesar de la extensa evidencia científica de la relación entre el cáncer de mama y el ejercicio físico, actualmente no existe consenso respecto a las siguientes variables, que podrían estar implicadas: período de exposición, tiempo de exposición crítica, intensidad, frecuencia y duración de la actividad física. En general, los estudios sobre actividad física y cáncer han tenido un control inadecuado de la intensidad y el volumen, lo que hace difícil la prescripción de ejercicio porque las respuestas fisiológicas y biológicas dependen de la carga de trabajo9. Algunos estudios recomiendan una actividad física vigorosa, mientras que otros proponen una actividad física de baja intensidad para reducir riesgos, hecho que no se puede demostrar fácilmente, dado que los grandes cambios hormonales ocurren durante el ejercicio de alta intensidad.
El ejercicio intenso actúa mejor sobre el control de los cambios en el metabolismo de los estrógenos, la masa corporal grasa, las adipocitoquinas, la densidad mamográfica, la función inmune y los sistemas de defensa antioxidante, además de reducir los niveles de hormonas estrógeno circulatorias endógenas (como exposición acumulativa) y reducir la glucosa y la circulación de la insulina (que puede afectar los niveles de IGF-1 y FBP y, de este modo, provocar una disminución de la biodisponibilidad de IGF-I14, un nivel más bajo de los marcadores inflamatorios, un aumento del umbral de ACTH y secreción de cortisol), además de mejorar la capacidad física y la CV.
Existe evidencia científica basada en estudios epidemiológicos, de caso control, revisiones sistemáticas y metaanálisis que manifiestan el mejor impacto de un programa de ejercicio aeróbico de alta intensidad en la reducción del riesgo de cáncer de mama. Una revisión de 57 estudios15 identificó una tendencia significativa de un menor riesgo de cáncer de mama con niveles cada vez más altos de actividad física. Un estudio más reciente, de 200816, en el que se analizaron 34 estudios de casos control y 28 estudios de cohorte, informó de una reducción del riesgo del 22% con un ejercicio de intensidad moderada y una reducción del 26% con un ejercicio de alta intensidad. La misma evidencia fue analizada en una revisión realizada por la World Cancer Research Fund International17, en la que se observó una asociación entre el aumento de la intensidad del ejercicio y la disminución del riesgo. Los estudios en animales han demostrado que el ejercicio de alta intensidad aumenta el tiempo de vida de los ratones portadores de tumor en 2,8 veces, y reduce la masa del tumor en un 10%18.
Métodos
El estudio se realizó en el laboratorio de fisiología del ejercicio en la Universidad Pedagógica Nacional, fue aprobado por el comité de ética de la Clínica del Country (Bogotá, Colombia) y se desarrolló en 3 fases. La primera fase consistió en establecer el estado basal sobre la calidad de vida, fatiga, fuerza, consumo máximo de oxígeno y concentraciones plasmáticas de IGF-I. A continuación, la segunda fase consistió en un programa de intervención que se realizó durante un período de 22 semanas, con 3 sesiones semanales de una hora cada una. Por último, la tercera fase, que tuvo lugar después de finalizar la cirugía, consistió en efectuar de nuevo las evaluaciones de la primera fase.
Estrategias de reclutamiento y criterios de elegibilidad
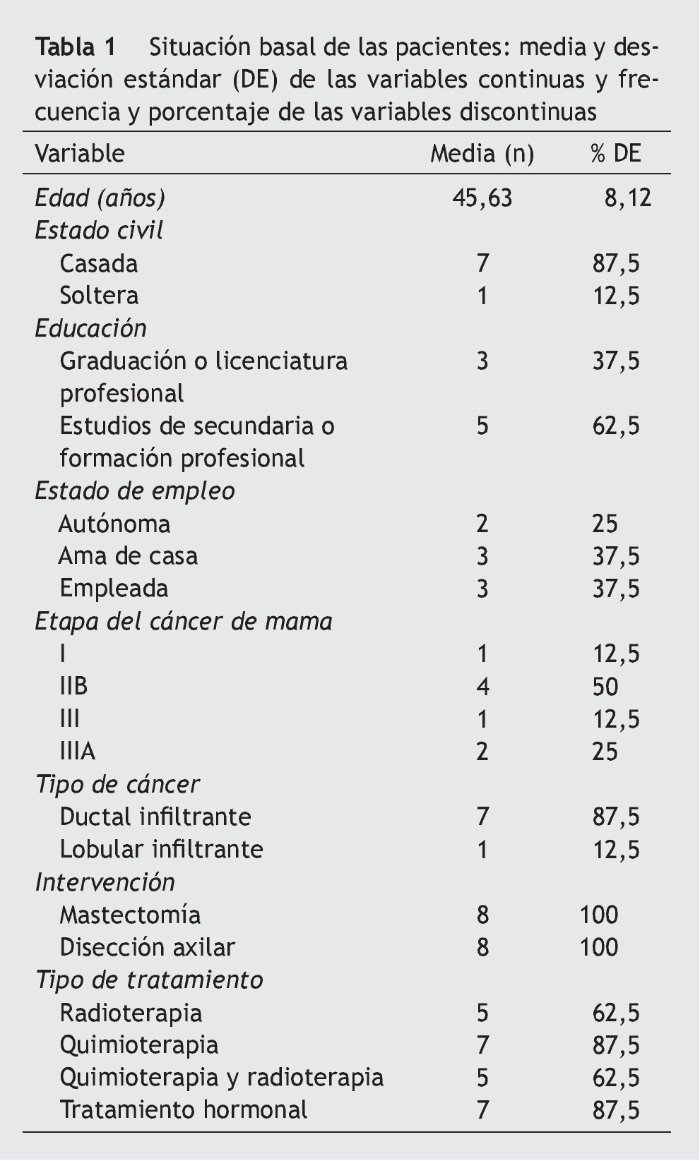
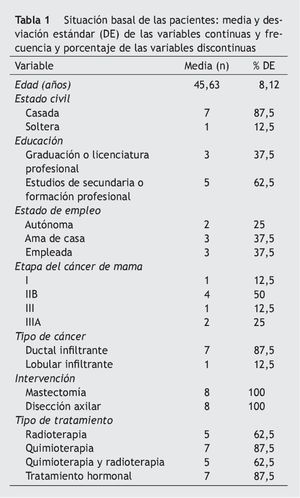
El grupo de participantes consistió en mujeres que vivían en Bogotá (Colombia) que habían sido diagnosticadas de cáncer de mama, habían completado la fase de la quimioterapia y/o radioterapia, se habían sometido a una mastectomía parcial o total con disección de los ganglios linfáticos, y se encontraban en la fase de terapia hormonal (tamoxifeno) y restricción de la función ovárica. La selección para este estudio se llevó a cabo a través de una campaña de publicidad anunciada en todos los centros oncológicos durante un período de 6 meses y en charlas informativas celebradas en las reuniones de la asociación de pacientes de cáncer de mama AMESE y la fundación Simmon (Bogotá). Solo acudieron 15 pacientes, de las cuales únicamente 11 cumplían con los criterios de inclusión y participaron voluntariamente en el estudio, sin recibir ningún incentivo económico. Los criterios de inclusión fueron los siguientes: pacientes con estadio cáncer 0-III que habían completado la radioterapia y/o quimioterapia y la cirugía, que no estaban en tratamiento de terapia con estrógenos, y que fueran capaces de realizar una actividad física regular. Fueron excluidas del estudio las mujeres que tenían enfermedades crónicas no controladas; las que estaban tomando hipotensores, diuréticos, antiinflamatorios, hormonas o hipolipemiantes; las fumadoras o bebedoras habituales, y las que participaban o habían participado en programas de ejercicio durante el año anterior. Todas las participantes fueron informadas de los pormenores del estudio y firmaron el formulario de consentimiento informado.
Programa de intervención
La intervención se llevó a cabo bajo la supervisión de especialistas en fisiología del ejercicio, que habían diseñado una rutina de ejercicios personalizada según la condición física de cada participante. Se realizaron 3 sesiones semanales individualizadas y supervisadas en el laboratorio de fisiología del ejercicio durante 22 semanas.
El entrenamiento aeróbico se realizó en una cinta de correr (Precor 5000; Precor, Woodinville, WA, EE. UU.). La intensidad se ajustó a la frecuencia cardíaca de reserva, según la fórmula propuesta por Karvonen19; la intensidad se fijó en un 60% durante las 6 primeras semanas, el 70% para las siguientes 6 semanas, y el 80% para las 9 semanas restantes. La frecuencia cardíaca se controló con un pulsómetro Polar Xtrainer Plus (Polar Electro, Kempele, Finlandia). El volumen de las sesiones fue incremental: durante las 4 primeras semanas tuvo una duración de 20 min, y posteriormente se aumentó la duración con incrementos de 5 min cada 3 semanas hasta alcanzar una duración de 50 min. Después de completar cada intervalo se aplicó la escala de Borg de esfuerzo percibido, modificada.
Debido a las características de la población, el programa de fuerza se inició a una intensidad del 10% de 1 RM en base a los resultados de estudios previos de mujeres SCM que habían completado las terapias complementarias y la cirugía. El volumen se mantuvo constante durante todo el programa, y se realizaron 2 series de 12 repeticiones con una recuperación de 2 min. En las primeras 6 semanas los ejercicios se realizaron al 10% de la fuerza máxima (1 RM); a partir de entonces, cada 4 semanas, la carga se incrementó en un 10%. El trabajo de fuerza incluyó extensión de codo (sentado), press de banca, y mariposa.
Antes y después de la intervención se llevaron a cabo las siguientes actuaciones:
Historia clínica
Un médico redactó la historia clínica y realizó la evaluación del estado de salud general de cada paciente certificando la participación sin riesgo en el programa. También se registró información adicional sobre el estado civil, el nivel de educación, la técnica quirúrgica, la situación laboral y la relación con el tipo de cáncer, la extensión y los tratamientos realizados.
Calidad de vida
Se realizó una presentación explicando con todo detalle cada uno de los cuestionarios utilizados para evaluar la calidad de vida, Functional Assessment of Cancer Therapy (FACT-B), SF-36 y Piper Fatigue Scale (PSF). Tras explicar cada instrumento y comprobar que las pacientes habían comprendido el propósito de los cuestionarios, se procedió a aplicar los instrumentos utilizando una metodología de autoadministración con el apoyo de personal del laboratorio entrenado para proporcionar claves y definiciones que ayudaran a las participantes si no entendían alguna de las preguntas. Se verificó que todas las preguntas fueran contestadas. Al finalizar el programa de entrenamiento, se llevó a cabo el mismo protocolo.
La versión española del FACT-B evalúa la percepción de la calidad de vida relacionada con la salud en pacientes de cáncer de mama en 5 dimensiones: bienestar físico (7 subescalas), bienestar social y familiar (6 subescalas), bienestar emocional (6 subescalas), bienestar funcional (7 subescalas) y problemas de salud. Asimismo se administró el cuestionario Short Form 36 Health Survey (SF-36) para evaluar la función física, el rol físico, el dolor corporal, la salud general, la vitalidad, la función social, el rol emocional y la salud mental. Además, el SF-36 incluye un ítem de transición de salud que pregunta sobre el cambio en el estado general de salud respecto al año anterior. El cuestionario PFS cuantifica la fatiga de acuerdo con 4 subescalas anímicas (behavioral/severity, affective meaning, sensory y cognitive/mood). Estos cuestionarios han sido ampliamente utilizados para evaluar la CV y la fatiga en pacientes de cáncer de mama.
Biomarcadores
Factor de crecimiento insulínico, IGF-I (somatomedina C): las concentraciones de IGF-I en la sangre se analizaron en el instituto de diagnóstico médico especializado IDIME, que utilizó el método ELISA (R & D Quantikine Human IGF-I ELISA Kit®) por su alta calidad y reproducibilidad. El primer análisis se llevó a cabo antes del comienzo del programa de entrenamiento, y el segundo se realizó 72 h después de la última sesión. Las 2 muestras se tomaron a las 8 de la mañana, antes del desayuno.
Actividad física
Al inicio del estudio, las participantes respondieron a 2 encuestas: una sobre sus niveles de actividad física en los últimos 6 meses y otra sobre su actividad física durante los últimos 7 días: 7-day Physical Activity Recall (7-day PAR).
Medidas antropométricas
La masa corporal se calculó con una balanza electrónica (Health o Meter®, de 50 g de precisión; Welch Allyn, Inc., Skaneateles Falls, Nueva York, EE. UU.) y la estatura con un tallímetro (Martin); el índice de masa corporal (IMC) se calculó con la fórmula IMC = peso (kg) / estatura (m)2. Los pliegues cutáneos del bíceps, tríceps, subescapular, suprailíaco, abdominal, muslo y gastrocnemio se midieron con un adipómetro Harpenden (Baty International, West Sussex, Reino Unido), y se calculó el sumatorio de pliegues. El perímetro muscular del brazo se evaluó con una cinta antropométrica Mabis. Todas las medidas fueron tomadas 2 veces por el mismo especialista, según la metodología de la International Society for the Advancement of Kinanthropometry (ISAK), y se registraron los valores medios.
Fuerza máxima dinámica
Dadas las características de la población y la escasa información disponible sobre la evaluación de la fuerza máxima de 1 RM en pacientes con cáncer de mama, se utilizó el método de entrenamiento de una rutina de 100 repeticiones, según la ecuación propuesta por Bryzcki: 1 RM = 100 repeticiones (102,78 − 2,78 reps.), validada por varios estudios.
La evaluación se realizó individualmente con pesos libres en cada brazo con los movimientos siguientes: extensión de codo (sentado), press de banca y mariposa.
El protocolo empezó con una carga baja de 1 kg. Las participantes realizaron las repeticiones, y la prueba se detenía cuando habían realizado al menos 10 intentos. A continuación se administró la escala OMNI-RES. Según la valoración de la paciente, la carga se aumentaba con incrementos progresivos de 0,5-1 kg. Para mejorar la exactitud de la estimación de la fuerza máxima, esta se determinó cuando la paciente no era capaz de realizar más de 8 repeticiones con la carga. Para evitar los efectos de la fatiga, se permitieron períodos de descanso de 2 min entre series.
Función física
La estimación del VO2max se realizó indirectamente en una cinta de correr Precor 5000 durante un entrenamiento progresivo y continuo que se inició a una velocidad de 5 km/h con una inclinación de 6%, que se incrementaba cada 2 min en un 2% hasta el agotamiento o hasta que las participantes experimentaban una intensa disnea, mareos, dolor en el pecho o una presión arterial o respuesta cardíaca anormales. Para calcular el consumo máximo de oxígeno se utilizó la ecuación propuesta por el American College of Sports Medicine (VO2max = 3,5 ml kg−1 min−1 + (vel m/min × 0,2) + (% inclinación × vel m/min × 1,8)20.
Análisis estadístico
Dado el tamaño de la muestra, se utilizaron estadísticas descriptivas para determinar el efecto de las variables de 22 semanas de entrenamiento. Los valores fueron descritos como mediana y desviación estándar para el análisis no paramétrico, y para las variaciones porcentuales se utilizó el test de Wilcoxon; el nivel de significación se estableció en p < 0,05.
Resultados
Los tests para determinar el estado basal se llevaron a cabo en enero de 2013, y el programa de intervención terminó en diciembre de 2013. Once pacientes comenzaron el programa, y 8 completaron el 97,8% de las sesiones de entrenamiento. Tres no completaron las sesiones debido a que tenían que ejercer otras obligaciones y no se tomaron en consideración en los resultados finales, ya que no fue posible realizar las mediciones finales después del ejercicio, aunque se consideraron las mediciones iniciales. Ninguna de las pacientes experimentó efectos adversos durante el curso del programa de entrenamiento.
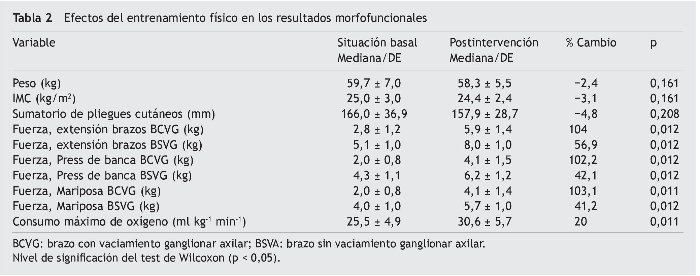
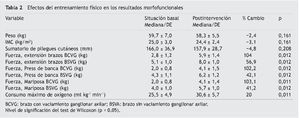
La tabla 1 registra las características sociodemográficas, las características del cáncer y los tipos de tratamiento recibido. Las tablas 2-4 presentan los resultados de las variables morfofuncionales, CV y medición de biomarcadores después del período de entrenamiento de 22 semanas. Después de un período de entrenamiento de 22 semanas, no se observaron disminuciones significativas en el peso, IMC y sumatorio de pliegues cutáneos. El consumo máximo de oxígeno mostró un aumento significativo de 5,1 ml/kg/min. En ambos brazos se produjo un aumento significativo de la fuerza con los 3 tipos de movimiento de la siguiente manera: flexión de codo (sentado) en el brazo sin vaciamiento ganglionar (BSVG) y en el brazo con vaciamiento ganglionar (BCVG), 2,9-3,0 kg, correspondiente a un aumento de la fuerza máxima del 56 y del 104%, respectivamente. En ejercicios de press de banca, en el BSVG y el BCVG se registró un incremento de 1,8 y de 2,1 kg, que representa un aumento de la fuerza máxima de un 42 y un 101%, respectivamente. En ejercicio de mariposa se registró un aumento de 1, 6 kg en el BSVG y de 2,1 kg en el BCVG, lo que representa un aumento de la fuerza máxima de un 41 y un 103%.
Calidad de vida
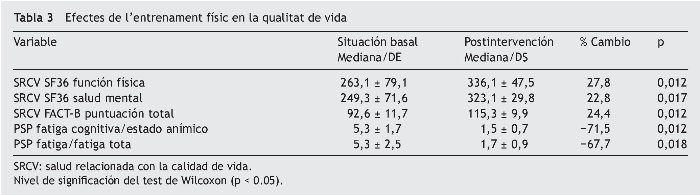
La tabla 3 presenta los resultados de la valoración de la CV de los sujetos antes y después del programa de entrenamiento. En el SF-36 se observa una disminución significativa del impacto de la enfermedad sobre la CV con un incremento de 73,1 puntos en el componente físico y 73,7 en el mental, correspondiente a un 25% de mejora total de la CV. La misma tendencia se observó en la puntuación total, que reveló que FACT-B disminuyó en 22,6 puntos, que corresponde a una mejora del 24%. También disminuyó el nivel de fatiga en 3,8 puntos en el estado anímico correspondiente a 3,6 puntos en el estado de fatiga total, equivalente a una reducción del 68% en la fatiga mostrada por estas pacientes antes de empezar el programa de entrenamiento.
La tabla 4 presenta los cambios de IGF-I en las concentraciones plasmáticas antes y después del entrenamiento. El programa condujo a una disminución significativa del 34 µg/ml, correspondiente a un 22% de reducción del biomarcador plasmático IGF-I.
Discusión
El aumento del consumo de oxígeno en SCM después del programa de entrenamiento se ha reportado en varios metaanálisis de ensayos aleatorizados controlados, que han observado aumentos significativos (p < 0,01) con valores entre 2,2 y 3,4 ml kg−1 min−1, equivalentes a incrementos entre un 13,8 y un 23%8,21. En nuestro programa de entrenamiento aeróbico, que utilizó un método fraccionado e intenso, se evidenció el mismo fenómeno, pero con un incremento medio del consumo de oxígeno de 5,1 ml kg−1 min−1, equivalente a un 20%.
Este valor más elevado de aumento del consumo de oxígeno obtenido en nuestro estudio en relación con los valores observados en estudios con otros grupos podría ser debido a una intensidad del ejercicio más elevada, lo que concuerda con la evidencia existente de que este tipo de ejercicio conduce a niveles más elevados del consumo máximo de oxígeno. En este nivel de intensidad se observan cambios cardiovasculares, incluido el aumento de la elasticidad arterial, de la capacidad cardiorrespiratoria, del gasto cardíaco y de los niveles de oxígeno arteriovenoso, así como la disminución de la frecuencia cardíaca de reposo (5,8% o superior) y el aumento de los niveles de enzimas oxidativas, densidades capilares y concentraciones de mioglobina.
No se consideran muy importantes los cambios funcionales y metabólicos inducidos por un entrenamiento al 60% de la frecuencia cardiaca máxima durante cortos períodos22.
Estos resultados más elevados también podrían ser debidos a un aumento de la carga de trabajo o al método de entrenamiento interválico utilizado; el programa se llevó a cabo en su totalidad en cinta de correr e implicó el grupo de pacientes más joven. Estos factores concuerdan con la evidencia existente que sugiere que estos elementos tienen un alto impacto en el consumo máximo de oxígeno.
El método fraccionado tiene grandes ventajas respecto al consumo de oxígeno. A nivel del corazón, la vena cardíaca menor trabaja a alta intensidad tanto durante la carga como en la recuperación. El esfuerzo que realiza el corazón en cada repetición a largo plazo ocasionará una hipertrofia del miocardio, mientras que los intervalos de descanso provocan una dilatación de las aurículas y los ventrículos. El entrenamiento fraccionado también tiene un gran impacto en los sistemas respiratorio y circulatorio (aumento de la elasticidad arterial y cardiopulmonar, gasto cardíaco y las diferencias arteriovenosas en oxígeno) para satisfacer la demanda de oxígeno requerida por los músculos.
La fuerza es un componente de la forma física que está estrechamente vinculado a la salud y a la CV. Esta relación es mucho más evidente en las SCM por los efectos negativos de las terapias adyuvantes y la cirugía. Hasta la fecha, ningún estudio ha establecido un régimen de entrenamiento de resistencia con cargas medias o altas para las SCM, muy probablemente debido a las preocupaciones clínicas con respecto a inducir o exacerbar el linfedema.
Las SCM que han sido objeto de disecciones ganglionares suelen experimentar limitaciones de la fuerza en el brazo afectado, hecho que les causa dificultades al levantar o transportar objetos, lo que reduce la función física y limita la capacidad de realizar actividades cotidianas y domésticas23.
Nuestra revisión bibliográfica reveló muy pocos estudios que incluyeran programas de fuerza en esta población. De 36 estudios identificados, solo 10 implementaron el entrenamiento de fuerza. Estos datos coinciden con los que se encontraron en la revisión de los programas de intervención que incluían el ejercicio físico en pacientes con cáncer de mama, realizada en 2010 por el ACSM, en la cual solo 11 de los 53 estudios incluían trabajo de fuerza24; una revisión sistemática realizada por Bataglini et al.21 en 2014 identificó 11 estudios.
Todas estas revisiones indican que se produce un incremento significativo de la fuerza después del programa de entrenamiento. Este hecho se confirma en el metaanálisis realizado en 2012 por Fong et al.8, quienes reportaron ganancias significativas en el press de banca (6 kg; p < 0,01), press de piernas (19 kg; p < 0,01), y de 3,5 kg en agarre (p ≤ 0,03).
Nuestro estudio es el primero en comparar la respuesta al entrenamiento del brazo con linfadenectomía en comparación con el brazo sin linfadenectomía. Se observó una mejor respuesta en el brazo con linfadenectomía (en comparación con la misma carga de entrenamiento). Nuestros resultados indican ganancias de un 56,9% en el rendimiento funcional del músculo del brazo sin linfadenectomía y una ganancia del 104% en el brazo con linfadenectomía. Estudios como el de Ahmed et al.25 han comparado el efecto del entrenamiento de la fuerza en la circunferencia de los 2 brazos en mujeres con cáncer de mama. Estos resultados se pueden atribuir a los cambios neuromusculares y/o hipertrofia muscular y tienen importantes implicaciones en las SCM porque las terapias utilizadas para tratar el cáncer pueden causar perturbaciones nerviosas periféricas que están asociadas a atrofia muscular26 y pueden conducir a generar linfedema. El entrenamiento de fuerza estimula los músculos esqueléticos, así como el drenaje linfático y venoso, y puede ejercer efectos positivos sobre las actividades simpáticas de los vasos.
Varios estudios27 han descrito que el cáncer de mama y sus tratamientos afectan significativamente a la CV a través de la alteración de la función física, el dolor corporal, la vitalidad, las funciones social y familiar, el bienestar emocional, la salud mental y la salud general.
Los resultados obtenidos en diferentes estudios y metaanálisis8,13 que analizan los efectos de un programa de actividad física sobre la calidad de vida en pacientes con cáncer de mama presentan gran heterogeneidad en los resultados. Algunos autores han reportado mejoras significativas después de la cirugía, y otros no. Sin embargo, a pesar de esta disparidad en los valores, se establece un consenso que indica que la mejora de la calidad de vida de estas pacientes se asocia con el aumento de la actividad física.
Estos diferentes resultados pueden ser atribuibles a varios factores, tales como la diversidad metodológica utilizada en cada intervención, es decir, el tipo de ejercicio, intensidad, frecuencia y duración de la intervención misma9.
Los efectos de nuestro programa de entrenamiento llevaron a una mejora global del 24,4% en la calidad de vida de estas pacientes, que se reflejó en un incremento de 23 puntos en la puntuación total en la escala de FACT-B y 73 puntos en la escala SF-36, valores que representan una diferencia importante clínicamente (DIC) teniendo en cuenta que a partir de 9 puntos se considera un efecto DIC. Al analizar por separado los resultados de los componentes que evalúa el SF-36 se observó un incremento del 27% en el componente físico y un aumento del 22% en el componente mental, con una puntuación de 85,6 en salud mental, de 83,1 en la función física y de 88,1 en la función social, resultados ligeramente superiores a los identificados en el metaanálisis de Fong et al8. El promedio de la puntuación en los estudios analizados para estas categorías fue 78, 82 y 84, con valores promedio del efecto de 2,4, 3,0 y 3,4, respectivamente.
En nuestra intervención, se identificó una disminución significativa de 67,7% en el estado de fatiga total, y un cambio de −3,51, mayor que los −3 puntos, fue considerado como CID importante. Este efecto positivo del ejercicio sobre la fatiga se ha observado en diferentes estudios y metaanálisis; también se ha identificado una disminución de la fatiga y mejora del estado de ánimo. Valenti et al.28 han descrito un efecto significativo (p < 0,001). Flude et al.29
obtuvieron p < 0,001. Cantarero et al.30 hallaron mejoras en el componente afectivo (F = 7,347, p = 0,002), sensorial (F = 5,199, p = 0,010), cognitivo (F = 9,001; p = 0,001), severidad (F = 3,377, p = 0,044) y puntuación total de la fatiga (F = 10,002, p < 0,001). Fong et al.8 observaron que la actividad física se asociaba a una ligera reducción de la fatiga (−1,0 −1,8 a −0,1, p = 0,03).
Si estos resultados son exactos, todos los estudios demuestran el efecto positivo del ejercicio en la reducción de la fatiga en SCM, pero difieren sobre la magnitud de este efecto.
La radioterapia y el consumo de tamoxifeno tienen efectos directos sobre el metabolismo que conducen a un aumento de la masa grasa corporal que, por lo general, se halla entre 2,5 y 11 kg. Este impacto metabólico del tratamiento puede afectar al 50-90% de mujeres y perdurar más de 6 meses después del tratamiento.
Los resultados muestran una gran heterogeneidad respecto al efecto de la actividad física en la regulación del peso corporal en estas pacientes. El metaanálisis de Fong et al.8 identificó una reducción del índice de masa corporal (IMC) (−0,4, −0,6 a −0,2; p < 0,01 y una reducción del peso (−1,1 kg, −1,6 a −0,6 kg; p < 0,001) después de un programa de actividad física. Estos resultados son compatibles con el metaanálisis de Speck et al.31, quienes también informaron de una disminución significativa del peso (−0,25, p = 0,05), pero este hallazgo no fue clínicamente importante.
En nuestro estudio observamos que el programa de entrenamiento llevó a una disminución del 2,4% del peso corporal, un 3,1% del índice de masa corporal y un 4,9% en el sumatorio de pliegues cutáneos. Sin embargo, estos resultados no son estadísticamente significativos (p < 0,16) ni representan una DIC, lo cual es consistente con los hallazgos reportados en ensayos clínicos y metaanálisis sobre ejercicio en pacientes con cáncer de mama8,21.
Esta significativa reducción del peso corporal puede ser debida a la combinación de 2 efectos: el aumento de la masa muscular y a que la actividad física produce un aumento de la masa grasa producida por el tratamiento con tamoxifeno. Estudios DEXA realizados han demostrado el impacto que tiene un programa de actividad física en pacientes de cáncer de mama en la reducción de la masa grasa32. Por otra parte, la duración y el gasto energético presumible de nuestro programa no hacían pensar que nuestras pacientes fueran a presentar cambios significativos en el peso corporal. Además, los grupos musculares empleados no supondrían un cambio importante de la masa muscular adquirida.
La disminución de la masa grasa disminuye significativamente el riesgo de recidiva del cáncer debido a los efectos nocivos de los adipocitos en el metabolismo del estrógeno, porque las toxinas y los fármacos se almacenan en el tejido adiposo, constituyendo una fuente continua de carcinógenos33. Estudios en pacientes de cáncer de mama han demostrado que el ejercicio intenso y la pérdida de masa grasa conducen a un cambio en el metabolismo del estrógeno34 y la disminución del metabolismo de la grasa abdominal, particularmente la grasa visceral, que parece ser más activa que los depósitos de grasa.
Los resultados de nuestro estudio revelaron una disminución de 8,11 mm en el sumatorio de pliegues, equivalente al 4,8%; estos valores no son estadísticamente significativos (p < 0,20) ni representan una diferencia clínica importante, lo cual concuerda con los resultados reportados en ensayos clínicos y metaanálisis del ejercicio físico en pacientes con cáncer de mama8.
Una de las características del cáncer de mama es el riesgo de recidiva. Por lo tanto, es necesario el seguimiento de los biomarcadores en las SCM; el IGF-I es uno de los múltiples biomarcadores para el cáncer de mama, y su incidencia en la etiología ha sido probada.
En su metaanálisis de 4 ensayos aleatorizados controlados sobre de cáncer de mama, Fong et al.8 identificaron una asociación entre la actividad física y una reducción significativa (p < 0,04) en los niveles séricos de IGF-I, a diferencia de los resultados no significativos reportados en estudios previos8. En otro metaanálisis, un caso demostró una pequeña disminución en los niveles de IGF-I al cabo de un año y un aumento en el grupo control31.
Fairey et al.11 dirigieron un estudio durante más de 15 semanas que incluía 3 sesiones de 35 min por semana a una intensidad del 70% y reportaron una disminución del 7,2% en el IGF-I en el grupo entrenado y un incremento del 3,71% en el grupo control. Los autores identificaron diferencias significativas entre los 2 grupos (−10,9%). Irwin et al.7 reportaron una disminución del 3% en los niveles plasmáticos de IGF-I en el grupo de ejercicio y un aumento del 5,5% en el grupo control, lo que representa una diferencia clínicamente significativa (p = 0,089). El programa de entrenamiento en ese estudio comprendía ejercicio aeróbico de intensidad moderada durante 150 min a la semana durante 24 semanas. Schmitz et al.32, en su estudio sobre un programa de entrenamiento de fuerza de 2 sesiones por semana durante 24 semanas, no observaron ningún efecto del ejercicio sobre los niveles de IGF-I.
Los resultados de estos estudios indican el efecto modulador del ejercicio físico sobre las concentraciones plasmáticas de IGF-I e IGFBP-3, lo que sugiere que el ejercicio provoca efectos fisiológicos en IGF-I e IGFBP-3, modula terapias similares11 y disminuye las concentraciones plasmáticas de IGF-I y, de este modo, se reduce el riesgo de recidiva.
Sin embargo, los efectos del ejercicio en los niveles plasmáticos de IGF-I e IGFBP-3 están relacionados con la intensidad y la duración del ejercicio.
Berg35, en sus estudios sobre el impacto del ejercicio físico en el IGF-I, concluyó que el ejercicio de intensidad baja y moderada de menos de 30 min de duración se asocia a un incremento moderado o a ningún cambio en el total de la IGF-I circulante. Por el contrario, el entrenamiento realizado a alta intensidad y con una duración superior a 45 min puede conducir a una reducción en las concentraciones totales y libres de IGF-I. Otras cuestiones adicionales están vinculadas con el tiempo transcurrido desde la finalización del ejercicio y el momento en que se obtiene la muestra de sangre, que puede variar según las fases anabólicas y catabólicas del IGF-I después del ejercicio35.
Una revisión sistemática36 que analizó 115 artículos sobre los efectos del ejercicio sobre el IGF-I en los diferentes tipos de poblaciones confirma esta discrepancia.
Unos niveles elevados de actividad física pueden reducir el riesgo de cáncer de mama a través de la vía de señalización de la insulina. El ejercicio reduce la circulación de la insulina y la glucosa, lo que puede afectar los niveles de IGF-I e IGFBP, que da lugar a una disminución de la resistencia a la insulina y la hiperinsulinemia. Este efecto puede reducir la biodisponibilidad de IGF-I y, así, reducir el riesgo de cáncer de mama14. Uno de los posibles mecanismos que se han propuesto para explicar este descenso de los niveles de IGF-I es que el ejercicio de resistencia aeróbica puede disminuir la resistencia a la insulina por varias vías, incluyendo un incremento en la señalización de aumento del receptor de insulina, aumento de la expresión de la proteína del transportador de glucosa y del ARNm, aumento de la glucogenosintasa y la hexoquinasa, disminución en la liberación y aumento en el aclaramiento de los ácidos grasos libres, incremento del índice de liberación de glucosa de los músculos en razón al aumento en la densidad capilar, y un cambio en la composición de los músculos para utilizar esta mayor disponibilidad de glucosa. Esta menor resistencia a la insulina puede disminuir los niveles de insulina circulantes y disminuir simultáneamente la biodisponibilidad de IGF-I, debido al aumento de la mediación de insulina, alterando así la concentración de IGBP-337.
La evidencia científica presentada muestra una asociación entre altos niveles de insulina e IGF-I y bajos niveles de IGFBP-3 y un aumento del riesgo de cáncer de mama o muerte asociada. Por tanto, es importante identificar los factores que pueden reducir los niveles de IGF-I. Las respuestas de la insulina y el IGF-I al ejercicio físico son la clave para mejorar el pronóstico de la paciente.
Conclusiones
Los resultados de este estudio indican que el ejercicio aeróbico de alta intensidad combinado con un entrenamiento de fuerza, 3 veces por semana, durante 60 min, más de 22 semanas, tiene un efecto positivo en la CV, la función cardiopulmonar, la función muscular y los niveles plasmáticos de IGF-I en SCM que han sufrido cirugía y tratamientos de radioterapia y/o quimioterapia y que reciben tratamiento de terapia hormonal.
Recibir tratamiento para el cáncer de mama no afecta a la capacidad de mejora de VO2max después de una sesión de entrenamiento aeróbico intenso, ya que en estas pacientes se observaron cambios positivos en las variables fisiológicas crónicas después de hacer ejercicio.
Las pacientes sometidas a mastectomía a menudo presentan asimetría funcional en la demostración de la dinámica de los grupos musculares que actúan sobre el hombro y el codo, en el lado de la fuerza máxima afectada. Como resultado del entrenamiento de fuerza, la mejora se produce en la manifestación de la fuerza en ambas extremidades superiores, aunque se produce una mejora adicional en la extremidad del lado afectado, que es probable que presente niveles iniciales de fuerza menores.
El entrenamiento físico en las mujeres tratadas por haber padecido cáncer de mama produce una mejora significativa de la calidad de vida percibida, si se mide con instrumentos para evaluar a la población general y con los desarrollados para medir las afectadas por el cáncer de mama. Estas mejoras se observan también en los elementos que exploran tanto los factores físicos como los psicológicos.
El ejercicio crónico personalizado mejora la percepción de la fatiga, que a menudo afecta a las mujeres que reciben tratamiento para el cáncer de mama.
El entrenamiento moderado de fuerza, combinado con el entrenamiento aeróbico intenso en mujeres que se han sometido a una mastectomía por haber sufrido cáncer de mama, produce una disminución significativa de los niveles plasmáticos de IGF; esta proteína se utiliza en clínica como un biomarcador del riesgo de recidiva del cáncer de mama.
Estudios posteriores deben determinar la relación dosisrespuesta, y el papel del ejercicio en SCM debería ser mejor entendido, porque los mecanismos biológicos subyacentes a la asociación entre actividad física y reducción en el riesgo de cáncer de mama están relacionados con la duración del ejercicio, la frecuencia, la intensidad y el tiempo de exposición.
Los programas de actividad física para pacientes supervivientes al cáncer deberían fomentar estrategias para lograr una buena adhesión al programa38.
Fortalezas y debilidades
Según nuestra revisión bibliográfica previa, este estudio es uno de los pocos que ha investigado los efectos de un programa de entrenamiento aeróbico de alta intensidad en SCM. Por lo tanto, hemos sido capaces de identificar un impacto positivo de este programa en SCM y validar la metodología y el seguimiento de los programas de entrenamiento. Sin embargo, este estudio está limitado por el bajo número de participantes y la falta de un diseño aleatorizado controlado, lo que produce limitaciones de control estadístico con respecto a la calidad de los análisis y la estratificación.
Estas limitaciones nos impiden inferir los efectos del programa de ejercicios en SCM. La presente investigación también está limitada porque no es un ensayo clínico controlado. El bajo número de participantes fue debido a las condiciones de implementación del programa. Además, solo se midió el biomarcador de IGF-I, y las mediciones intermedias no se tomaron para identificar los efectos del ejercicio durante el período de entrenamiento. Deberían llevarse a cabo estudios que implicaran un mayor número de biomarcadores, tales como la insulina y la IGFBP-3 y sus citoquinas asociadas. A lo largo del desarrollo del programa deben obtenerse varias mediciones de estos biomarcadores para detectar la duración del ejercicio físico, la intensidad y la frecuencia requerida para influir positivamente en los biomarcadores. Del mismo modo, es necesario llevar a cabo un mayor número de estudios que impliquen diferentes niveles de intensidad, que permitan la confirmación de un efecto de dosis-respuesta del ejercicio aeróbico sobre los niveles de estos biomarcadores.
Financiación
La investigación fue financiada por la Universidad Pedagógica Nacional de Colombia; los autores no han recibido ninguna recompensa económica y ni el manuscrito ni el resumen han sido presentados a otros medios de información.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
Recibido el 4 de agosto de 2015;
aceptado el 27 de octubre de 2015
* Autor para correspondencia
Correo electrónico: jairofdz@gmail.com (J.A. Fernández Ortega).