Introducción: La fisiopatología de la tendinopatía rotuliana no es del todo conocida. Es difícil obtener muestras clínicas de deportistas que permitan conocer el desarrollo de la tendinopatía, sobre todo en las primeras etapas. Por este motivo, el propósito de este estudio es desarrollar, en una primera fase, un modelo experimental de tendinopatía rotuliana en ratas que simule la tendinopatía humana mediante la aplicación in vivo de colagenasa en la porción proximal del tendón rotuliano.
Material y métodos: El modelo experimental utilizado fueron ratas Wistar macho de 8 semanas de edad (n = 4). La administración de colagenasa se realizó, tras anestesia e inmovilización de los animales, mediante punción guiada por ecografía a nivel de la porción proximal y profunda del tendón rotuliano. La lesión tendinosa se evaluó 48 h después de la lesión mediante resonancia magnética, tras lo cual se procedió a la eutanasia de los animales y a la extracción de los tendones rotulianos para su evaluación histológica.
Resultados: El modelo de lesión inducida con colagenasa demostró similitud a nivel de la histología con la tendinopatía rotuliana humana en la región de su inserción proximal.
Conclusiones: El modelo experimental de tendinopatía rotuliana en ratas induce la degeneración y distorsión de la arquitectura del tendón rotuliano en su porción proximal, situación similar a la observada en la tendinopatía rotuliana humana, y representa un excelente modelo preclínico para el estudio de nuevas terapias enfocadas al tratamiento de la tendinopatía.
Introduction: Patellar tendon pathophysiology is not still fully understood. The collection of clinical samples from athletes that could permit the analysis of the tendinopathy progression, especially in the early stages, is difficult. For that reason, the purpose of this study is to develop a new experimental animal model of patellar tendinopathy in rats which mimics the human tendinopathy by in vivo intratendinous collagenase injection in the proximal portion of the patellar tendon.
Material and methods: The experimental model used was 8-week-old male Wistar rats (n = 4). The administration of collagenase was performed by ultrasound-guided puncture at the level of the proximal and deep portion of the patellar tendon in anesthetized animals. The tendon lesion was evaluated 48 h after injury by magnetic resonance and then, the animals were euthanized and the patellar tendons were collected for histological evaluation.
Results: The collagenase-induced lesion model demonstrated important similarities with the human patellar tendinopathy in the region of the proximal insertion.
Conclusions: The experimental model of patellar tendinopathy in rat model induces a degeneration and distortion of the patellar tendon architecture in its proximal portion, which closely mimics to that seen in human patellar tendinopathy, and could represent an excellent preclinical model for the study of new therapies focused on treatment of tendinopathy.
Introducción
La tendinopatía rotuliana fue descrita por primera vez por Blazina en 1973 como «rodilla del saltador»1. Es una patología frecuente que afecta a la inserción proximal del tendón rotuliano y es una de las formas más comunes de tendinopatía crónica en deportistas2. Aunque se han propuesto numerosas teorías, las causas de la fisiopatología de la tendinopatía rotuliana todavía son poco conocidas3,4.
Cook y Purdam5 propusieron un modelo basado en el continuum de la patología tendinosa. Este modelo considera 3 fases que pueden sobreponerse e interconectarse a lo largo del tiempo: tendinopatía reactiva, deterioro del tendón (fallo del proceso de cicatrización) y tendinopatía degenerativa. Este modelo propone que la carga de trabajo del tendón desempeña un papel esencial al inicio y en la progresión de la tendinopatía5. Los resultados que se encuentran comúnmente en deportistas son una tendinopatía degenerativa, caracterizada por un aumento de la matriz no colágena (proteoglicanos), degeneración mucoide con fibrosis variable, neovascularización y aumento de la celularidad debida a los fibroblastos6. Por otro lado, Fu et al.7 también propusieron un modelo de tres etapas caracterizado por una lesión inicial, un proceso de cicatrización y una manifestación clínica ineficaz. A pesar de la importancia clínica de la tendinopatía, su fisiopatología y evolución clínica siguen siendo poco conocidas, lo que restringe las intervenciones terapéuticas. El avance en el conocimiento y la comprensión de la evolución clínica de la tendinopatía presenta importantes limitaciones, no solo en los obstáculos para obtener muestras de tejido humano de deportistas, sino también debido a que estas muestras representan solo las etapas finales de los procesos patológicos con un inicio y duración no revelados8-10. Por esta razón, se han propuesto varios modelos animales para el estudio de la tendinopatía, aunque sus similitudes con la tendinopatía humana y su idoneidad para estudiar la fisiopatología del tendón rotuliano todavía son controvertidos11-13.
Se han descrito varios modelos animales para estudiar la tendinopatía rotuliana, como las lesiones del tendón inducidas quirúrgicamente14-22, inyección intratendinosa de colagenasa23-31, por administración de sustancias biológicas32,33 o inducida por sobrecarga34-36. Sin embargo, la mayoría de ellos se utilizan para verificar los abordajes terapéuticos y solo unos pocos se usan para describir los mecanismos patológicos de la tendinopatía rotuliana. Por esta razón, el presente trabajo propone la creación de un nuevo modelo animal capaz de reproducir la tendinopatía rotuliana de la porción proximal profunda que se observa comúnmente en deportistas. Este modelo podría permitirnos estudiar y comprender la evolución patológica de la tendinopatía en su porción proximal, así como evaluar la efectividad de nuevas intervenciones terapéuticas para fomentar los procesos de regeneración del tendón rotuliano.
Material y métodos
Animales
El modelo animal experimental utilizado fueron ratas Wistar macho de 8 semanas (Harlan). Se usaron un total de 4 animales. Las ratas se mantuvieron a 22-24 °C en ciclos de 12 h de luz/oscuridad, con acceso sin límite a comida y agua. Todos los procedimientos se llevaron a cabo de acuerdo con las legislaciones española (Real Decreto 53/2013) y europea (2010/63/EU) y aprobados por el Departament d’Agricultura, Ramaderia, Pesca, Alimentació i Medi Natural del Gobierno Catalán (Generalitat de Catalunya).
Modelo de lesión basado en la colagenasa
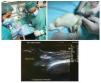
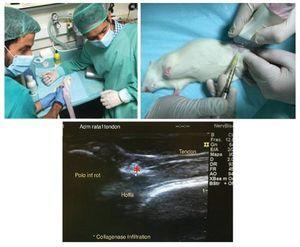
Los animales fueron anestesiados mediante inyección intraperitoneal de una mezcla de ketamina (75 mg/kg) y xilazina (10 mg/kg) y colocados en posición supina, con la articulación de la rodilla izquierda hacia arriba, antes del procedimiento quirúrgico. El proceso quirúrgico de producción de la lesión del tendón rotuliano se ilustra en la figura 1. La articulación de la rodilla se rasuró previamente y se esterilizó con alcohol al 70%. La lesión del tendón se generó mediante inyección guiada por ultrasonido de una solución de colagenasa al 10% disuelta en solución salina previamente filtrada para esterilización con un filtro de 0,22 µm (Nalgene), usando una aguja de 29 G (0,33 mm de diámetro interno). La intervención se realizó en el lado anterior de la rodilla, insertando la aguja en la porción proximal del tendón hasta llegar a las fibras profundas. Una vez en el área seleccionada, se liberaron 20 µl de solución de colagenasa en el área de inserción proximal del tendón (fig. 1). Después de la intervención quirúrgica, se administró analgesia posquirúrgica (buprenorfina 0,01 mg/kg) por vía subcutánea a todos los animales. Nuestro estudio siguió los estándares éticos en el deporte y la investigación en ciencias del deporte37.
Figura 1 Modelo de lesión basado en la aplicación de colagenasa. Se administró una dosis de colagenasa en la porción proximal profunda del tendón rotuliano con infiltración guiada por ultrasonido (*).
Análisis mediante resonancia magnética
Se realizaron estudios de resonancia magnética 1H in vivo en la Universitat Autònoma de Barcelona (UAB, Barcelona, España) usando BioSpec 70/30 USR (7T) de Bruker (Bruker BioSpin GmbH, Ettlingen, Alemania) con un miniequipo de resonancia con gradiente (400 mT/m) y una bobina transceptora de cuadratura de 72 mm de diámetro interno.
Las ratas se colocaron en un lecho, lo que permitió el suministro de anestesia (isoflurano, 1,5-2,0% en O2 a 1 l/ min), con un circuito de agua caliente integrado para la regulación de la temperatura corporal. La temperatura corporal se midió con una sonda rectal y se mantuvo a 37 ±1 °C. Se controló la frecuencia respiratoria con una sonda de presión y se mantuvo entre 60 y 80 respiraciones/min. Se obtuvieron inicialmente imágenes rápidas de eco de espín de baja resolución, calibradas en T2, en planos axial, sagital y coronal para ser utilizadas como imágenes scout de referencia. Los parámetros de imagen de estas imágenes fueron: tiempo de eco efectivo (TEeff) = 36 ms; tiempo de repetición (TR) = 3 s; longitud del tren de ecos (ETL) = 8; campo de visión (FOV) = 6 × 6 cm2; tamaño de la matriz (MTX) = 128 × 128; grosor de corte (ST) = 2 mm; separación entre cortes (gap) = 0,5 mm; número de cortes de imágenes (NS) = 25 axiales, 10 sagitales, 11 coronales; número de medias (NA) = 1. Se obtuvieron imágenes de eco de espín rápido de alta resolución en T2 en planos sagitales que contenían la lesión y el lado contralateral. Los parámetros experimentales de estas imágenes fueron: TEeff = 30 ms; TR = 4 s; ETL = 8; FOV = 3,2 × 3,2 cm2; MTX = 256 × 256; ST = 1 mm; gap = 0,1 mm; NS = 18; NA = 12; tiempo experimental = 25 min 36 s. Los datos de resonancia magnética se obtuvieron y fueron procesados en un ordenador con el sistema operativo Linux mediante el software Paravision 5.1 (Bruker BioSpin GmbH, Ettlingen, Alemania) (fig. 2).
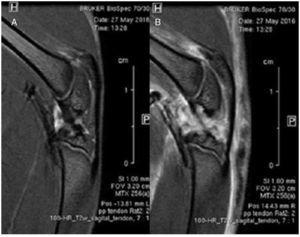
Figura 2 Durante les pruebas de resonancia magnética se controló la temperatura y la frecuencia cardíaca a los animales anestesiados. Se obtuvieron imágenes sagitales en alta resolución de secuencias rápidas de eco de espín ponderadas en T2 de los tendones lesionados rotuliano y contralateral.
Análisis histológico
Los animales fueron sacrificados 7 días después de la lesión mediante la administración intraperitoneal de una sobredosis de ketamina (75 mg/kg) y xilazina (10 mg / kg). Inmediatamente se extrajeron los tendones de ambas piernas desde la rótula a la inserción de la tibia, incluyendo la almohadilla grasa de Hoffa. Las muestras se congelaron en 2-metilbutano (Alfa Aesar, Johnson Matthey Company, Karlsruhe, Alemania) previamente sobreenfriadas en nitrógeno líquido y almacenadas a −80 °C hasta su uso. Las muestras de tendón se seccionaron longitudinalmente (10 µm de espesor) utilizando un criotomo (Leica Microsystems, Wetzlar, Alemania) a −20 °C y se montaron en un portaobjetos de Polilisina® (VWR, Lovaina, Bélgica). Para el análisis histológico se utilizaron secciones consecutivas de tendones congelados. Se realizó la tinción de las muestras con hematoxilina-eosina (1 min de hematoxilina y 15 s de eosina), se lavaron con agua y se deshidrataron con soluciones de gradiente de etanol (1 × 50% de etanol, 2 × 70% de etanol, 2 × 90% de etanol, 2 × 100% de etanol, 1 min cada uno) y se aclararon con xileno (5 s). Después del secado con aire, los portaobjetos se montaron con un medio DPX y un cubreobjetos (VWR, Madrid, España). Se obtuvieron microfotografías a través de un microscopio BX-61 (Olympus) equipado con una cámara DP72 (Olympus) y el software de tratamiento digital de imágenes CellSens® (versión 1.9).
Resultados
Análisis de la lesión del tendón rotuliano mediante resonancia magnética
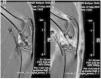
Se compararon imágenes sagitales mediante resonancia magnética de tendones rotulianos sanos y lesionados. No se detectaron diferencias de alineamiento o grosor de las fibras tendinosas a lo largo del tejido del tendón. Se observó edema difuso que afectaba principalmente a las estructuras articulares y musculares (fig. 3).
Figura 3 Estudio comparativo mediante resonancia magnética. No se encontraron diferencias en la estructura del tendón rotuliano sano (A) y el tendón lesionado (B).
Análisis macroscópico de la lesión del tendón
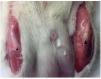
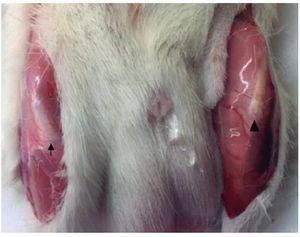
Se encontraron diferencias macroscópicas manifiestas entre tendones sanos y lesionados. Así, el tendón sano evidenciaba un color blanco brillante e intenso y una fuerte consistencia, mientras que el tendón lesionado presentaba un color marrón amarillento y una apariencia gelatinosa. Se observó que los tejidos periarticulares, principalmente los músculos esqueléticos adyacentes, presentaban cambios de color y consistencia (fig. 4).
Figura 4 Análisis microscópico. Comparación del tendón sano (izquierda) y del lesionado (derecha). El tendón lesionado es de un color marrón amarillento y de una apariencia gelatinosa (flecha y cabeza de flecha).
Análisis histológico del tendón rotuliano
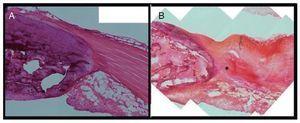
El tendón contralateral sano mostró un aspecto uniforme, presentando fibras de colágeno compactas y bien alineadas. Los tenocitos mostraron forma de huso y se localizaron en paralelo a la muestra de fibras tendinosas. La estructura de la grasa de Hoffa mostró características normales. Por el contrario, en el tendón lesionado se observó claramente una degeneración de la estructura de la fibra de colágeno, mostrando también una estructura ondulada evidente y espacios vacíos entre los haces de fibras adyacentes al nivel del tercio proximal del tendón rotuliano. También se observó una fragmentación parcial de las fibras del tendón en el lugar de la inyección. Asimismo, se detectó una clara desorganización del tejido graso de Hoffa, lo que sugiere su afectación y alteración como consecuencia de la administración de colagenasa (fig. 5).
Figura 5 Estudio histológico comparativo del tendón sano (A) y del lesionado (B). El tendón lesionado presenta degeneración de la estructura del colágeno en el lugar de la punción (*).
Discusión
El principal hallazgo del presente estudio fue la demostración de la similitud de las alteraciones estructurales del tendón rotuliano de la rata, tratado con colagenasa, caracterizado por la desorganización de las fibras de colágeno y estructuras adyacentes, con respecto a la tendinopatía rotuliana observada en la clínica de los humanos. Estos resultados sugieren que la administración de una única dosis de colagenasa infiltrada guiada por ecografía es eficaz para reproducir exactamente los cambios estructurales en la integridad de la región proximal del tendón rotuliano de la tendinopatía rotuliana humana.
Por primera vez, se generó un modelo animal que imita la degeneración del tejido tendinoso en el lugar anatómico más común observado en la tendinopatía rotuliana humana. Se han desarrollado otros modelos animales de tendinopatía para inducir la degeneración tisular en la parte media del tercio del tendón rotuliano a través de una «ventana» creada quirúrgicamente14-22. Este mecanismo de lesión no reproduce la lesión detectada en clínica humana, ya que los defectos creados quirúrgicamente se generan en áreas tendinosas distintas al sitio más común donde se produce la patología tendinosa, por lo que se plantea la hipótesis que los mecanismos de reparación del tendón de estos modelos no reproducen la patología del tendón sometido a cargas de trabajo repetitivas35,38. Nuestro modelo está dirigido a imitar la degeneración de las fibras proximales profundas, ya que tanto la biomecánica como la relación de la región proximal del tendón rotuliano con las estructuras adyacentes, principalmente con la almohadilla grasa de Hoffa, son importantes, no solo para el desarrollo de la tendinopatía, sino también en los procesos de cicatrización del tendón39,40.
Se considera que la carga de trabajo excesiva del tendón durante un entrenamiento físico intenso es la causa principal de la degeneración patológica41. Por esta razón, se ha utilizado el entrenamiento como modelo para inducir la tendinopatía rotuliana36,42,43. El principal inconveniente de esta técnica se basa en la necesidad de pasar un largo perío do de tiempo en entrenar a los animales con el fin de desarrollar los cambios patológicos característicos de la tendinopatía rotuliana humana. En nuestra opinión, sería interesante crear un modelo combinado de degeneración del tendón rotuliano basado en una lesión inicial mediante inyección intratendinosa a base de colagenasa en la región proximal profunda seguida de un período de entrenamiento físico intenso con el fin de inducir más rápidamente la degeneración patológica característica del tendón rotuliano. Datos previos reportados en modelos de tendinopatía de Aquiles generados por la administración de colagenasa peritendinosa guiada por ecografía sugieren que la administración de colagenasa puede conducir a tendinopatía en ratas y que la elastasa también podría estar implicada en el desarrollo de tendinopatía crónica44.
En nuestro estudio existen algunas limitaciones. La primera es la pequeña cantidad de animales (n = 4) utilizada en el estudio. En segundo lugar, debería optimizarse la dosis de colagenasa para reproducir exactamente los cambios característicos en la tendinopatía rotular humana y prevenir el daño colateral de estructuras adyacentes al tendón. Perucca Orfei et al.45 generaron un modelo en el tendón de Aquiles de los ratones que reproduce estrechamente los cambios histológicos observados en la tendinopatía de Aquiles en humanos. Evaluaron el efecto de dos dosis de colagenasa administrada intratendinosa (1 y 3 mg/ml). Aunque ambas dosis indujeron a la desorganización de las fibras de colágeno y al aumento de la celularidad, el tratamiento con mayor dosis de colagenasa pudo inducir una mayor neovascularización y degeneración de la grasa, siendo también cambios dependientes del tiempo. En nuestro estudio estos cambios no se observaron, ya que el tiempo transcurrido desde la administración de colagenasa al análisis de tendones fue más corto. Además, Perucca Orfei et al. presentaron el tendón mediante una incisión longitudinal de la piel, mientras que nosotros utilizamos una técnica mínimamente invasiva basada en la aplicación de colagenasa guiada por ecografía para inducir tendinopatía en la región de las fibras proximales profundas específicas del tendón rotuliano con la perturbación mínima de las estructuras y tejidos de la articulación de la rodilla. Además, nuestro análisis realizado por resonancia magnética demuestra que el efecto de la colagenasa no se localiza exclusivamente a nivel del tendón, sino que también podría afectar a las estructuras periarticulares, circunstancia que no se ha discutido en estudios anteriores.
En resumen, nuestro estudio sugiere que la administración de una solución de colagenasa guiada por ecografía en la región proximal profunda del tendón rotuliano podría constituir un modelo coherente para reproducir la degeneración y los cambios habitualmente vistos en la tendinopatía rotuliana en humanos. Este nuevo modelo también nos permitirá desarrollar nuevas terapias dirigidas a mejorar y curar la tendinopatía rotuliana como un paso previo para iniciar ensayos clínicos en pacientes humanos.
Financiación
Este artículo no ha contado con ninguna fuente de financiación.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses directamente relacionado con el contenido de este artículo.
Agradecimientos
Los autores agradecen al Departament de Cirurgia de la Facultat de Medicina de la Universitat Autònoma de Barcelona (UAB). En el momento de la redacción de este estudio, David Domínguez era estudiante de doctorado de la UAB y este trabajo forma parte de su tesis doctoral realizada en dicho departamento bajo la dirección y supervisión del Dr. Gil Rodas y el Dr. Mario Marotta.
Recibido el 22 de diciembre de 2016;
aceptado el 11 de enero de 2017
Correo electrónico:david.dominguez@fcbarcelona.cat (D. Domínguez)