Este artículo presenta como el ejercicio físico es una terapia complementaria en el tratamiento del cáncer próstata. En concreto presentamos el diseño e implementación de un programa de ejercicio físico de fuerza-resistencia adaptado al cáncer de próstata. El modelo base corresponde a la guía de la American College Sports Medicine Position Stand (ACSM 1998). La adaptación y transformación del programa incluye los síntomas más habituales relativos a la enfermedad y sus tratamientos.
Material y métodosEl diseño del estudio es casiexperimental la muestra es de 33 participantes en fase de tratamiento. Las variables de estudio son las variables antropométricas, fuerza-resistencia, tensión arterial, fatiga, incontinencia, dolor y Calidad de Vida.
ResultadosAl finalizar 24 semanas de programa, se observa una mejora significativa de la capacidad de la fuerza-resistencia, más evidente en las extremidades inferiores. También mejora la hipertensión arterial, la incontinencia urinaria y dolor.
ConclusionesEstos resultados demuestran que la mejora de la Calidad de Vida viene mediada por la mejora de la capacidad física y funcional del enfermo.
This article presents how physical exercise can be considered as a complementary treatment in prostate cancer. The article presents the design and implementation of a strength-endurance physical exercise program adapted to prostate cancer. The initial model corresponds to the guidelines of the American College of Sports Medicine (ACSM 1998). Adapting and transforming the program included the most common symptoms relating to the illness and its treatments.
Material and methodsThe study design is quasi-experimental. The sample consisted of 33 subjects in treatment phase. Study variables were anthropometric measures, strength-endurance, hypertension, fatigue, incontinence, pain and quality of life.
ResultsAfter 24 weeks of the program, a significant improvement in the strength-endurance capacity was observed. This result was more evident in lower limbs. There were also improvements in hypertension, urinary incontinence and pain. In conclusion, the improvement in quality of life is due to the improvement of the functional and physical capacity of ill person.
La inactividad y el sedentarismo de la población generan un problema sanitario, social y económico. Por este motivo, el objetivo principal del plan de acción de la National Institut of Health (NIH) y la American College Sports Medicine (ACSM), es promocionar la actividad física en todos los grupos de población para mejorar la salud y prevenir la enfermedad. El objetivo final es mejorar la habilidad de rendir en las tareas de la vida diaria, reduciendo el riesgo de sufrir patologías asociadas a un estilo de vida sedentaria, como por ejemplo la patología coronaria, la obesidad, diabetes tipo 2, hipertensión, el derrame cerebral y el cáncer1. Las recomendaciones generales, son parecidas a la propuesta de La Asociación Americana del Corazón (AHA), el Centro de Control y Prevención de la Enfermedad (CDC)2. Actualmente se pueden identificar tres grandes perspectivas sobre la relación entre la actividad física y la salud: una perspectiva rehabilitadora, una perspectiva preventiva y una perspectiva orientada al bienestar. Desde la perspectiva rehabilitadota, Airaska3 determina que la actividad física se puede considerar como un instrumento, a través del cual se puede recuperar la función corporal enferma o lesionada y paliar sus efectos sobre el organismo humano. Se puede comparar la actividad física con la función de un medicamento. En este sentido, se puede considerar la actividad física como una terapia complementaria a la terapia médica farmacológica para patologías como las coronarias, la obesidad, la diabetes tipo 2, la hipertensión, el derrame cerebral y el cáncer.
En este artículo nos centraremos en la perspectiva rehabilitadora de la actividad física en relación al cáncer de próstata para la mejora de la calidad de vida (CDV) de las personas en tratamiento por la enfermedad.
Teniendo en cuenta que el principal factor de riesgo en el cáncer de próstata es la edad, con una media de edad en la fase de diagnostico de 75 años, seguido de las influencias ambientales y los estilos de vida4 con un porcentaje de supervivencia relativa a los 5 años (76,5%), y que el estado de morbilidad que generan los tratamientos es muy elevado, actualmente, el objetivo prioritario en la intervención sociosanitaria es la mejora de la CDV del hombre mayor con cáncer de próstata5.
La CDV es un concepto multidimensional subjetivo, dinámico, de paradigma modular y de difícil medida6. La CDV relativa al cáncer (CDVRC) es la experiencia subjetiva de la enfermedad, contrastada con las expectativas, valores e intereses individuales7 y corresponde con la dialéctica que se establece entre aspectos subjetivos y objetivos. El resultado de esta relación determina la apreciación o satisfacción del funcionamiento actual del enfermo con el percibido como posible o ideal8.
El corpus de investigación demuestra que el diseño de un programa de ejercicio de fuerza-resistencia como terapia complementaria para el enfermo de cáncer de próstata disminuye hasta revertir la situación descondicionamiento físico y psicosocial mejorando la CDV del hombre mayor9,10,11. La mayoría de programas revisados se basan en la guía general que recomienda la American College Sports Medicine-Position Stand, destinada a la promoción del ejercicio en personas mayores sanas12. Los programas vigentes no consiguen adaptarse específicamente a la enfermedad y a sus tratamientos, resultando excesivamente genéricos, incompletos, poco flexibles a los síntomas y de baja eficacia13.
La efectividad del programa está supeditada a la gestión y el control de las variables que determinan las características de la actividad. Estas variables han de ser adaptadas y transformadas en base a los síntomas más habituales identificados en el proceso de enfermedad y tratamiento de cáncer de próstata y a la comorbididad del hombre mayor14. La consideración de estos aspectos, facilita la compatibilidad del programa de fuerza-resistencia con el cáncer de próstata y su promoción para paliar el descondicionamiento e incapacidad que genera la enfermedad y el tratamiento15. A partir de un programa de estas características se observaría una mayor eficacia en el aumento de la capacidad de fuerza-resistencia muscular y su transferencia en la calidad de los patrones motores básicos16,17 retrasando el proceso de fatiga, disminuyendo el proceso de osteopenia y osteoporosis provocado por la asociación de los factores edad, tratamiento hormonal e inactividad, disminuyendo el riesgo del encadenamiento caída-fractura-dependencia, en la cual se encuentran los hombres frágiles enfermos18, consiguiendo mejorar la CDV y supervivencia del hombre mayor con cáncer de próstata19.
Este artículo tiene como objetivos:
1. Presentar un programa de ejercicio fuerza-resistencia adaptado al cáncer de próstata considerando las variables significativas de los estudios destinados a gente mayor sana o enferma de patología no cancerígena.
2. Evaluar los resultados físicos y psicosociales conseguidos después de 24 semanas del programa.
Tras obtener el informe favorable del comité ético de investigación, el programa de ejercicio se realizó en el Hospital de Figueres (España), desde el mes de octubre de 2006 al mes de octubre de 2007.
Para la inclusión de los sujetos en el programa es necesario que cumplan tres condiciones:
1. Se requiere el diagnóstico histológico de cáncer de próstata, en cualquier estadio de la patología en fase de tratamiento.
2. Haber superado el examen médico preinterventivo en el que declara que el enfermo no presenta ninguna de las contraindicaciones incompatibles con el programa de ejercicio.
3. Firmar el consentimiento informado del interesado.
Los criterios de exclusión son la presencia de cualquier patología que contraindique la práctica temporal o permanente del ejercicio físico, destacando como contradicciones absolutas, los grupo iii y iv enfermedad cardiaca según la clasificación de la New York Heart Association, la hipertensión arterial descontrolada, dolor, enfermedad psiquiátrica y la imposibilidad de entender o hablar el español.
Aleatoriedad en la selección de la muestraLa muestra corresponde a 36 participantes. La selección es aleatoria entre los participantes que se encuentran en fase de tratamiento y a partir del número de la historia clínica y aplicando el programa SPSS v5.
Intervención programa de ejercicioLas características del programa son la duración de 24 semanas. Dieciséis semanas de control directo a indirecto del profesional de educación física y 8 semanas de trabajo autónomo. La frecuencia de trabajo es de 2 sesiones semanales de 90min, en las cuales se incluyen una o 2 series de 8 a 12 repeticiones de 10 ejercicios correlativos correspondientes al trabajo de la musculatura de: cuadriceps, pectoral, isquiotibiales, deltoides, abdominales (hipopresivos), bíceps, tríceps, 2 dorsales y musculatura del suelo pélvico incluyendo la conciencia y el control de la musculatura del suelo pélvico y el posterior refuerzo a partir del trabajo originado en la musculatura sana y el desbordamiento de energía desde la musculatura sana a la zona muscular del suelo pélvico debilitada. La intensidad de trabajo es entre el 50–70% del 8RM previamente calculado con el test de Lander20. La progresión ascendente se rige con el incremento consecutivo de repeticiones, series y peso. Al sobrepasar las 12 repeticiones en la segunda serie se puede aumentar el peso, siempre y cuando el incremento de peso semanal no sobrepase el 10% del 8RM. Es estrictamente obligatorio no sobrepasar el umbral del 70% del 8RM para evitar el riesgo de secreción de testosterona. Además se considera la percepción individual de la intensidad del esfuerzo controlado a partir de la escala modificada de percepción subjetiva del esfuerzo de Borg CR-1021. De esta manera resulta un programa flexible que se adapta a cada enfermo teniendo en cuenta su capacidad y funcional, el estado de la enfermedad y sintomatología.
Evaluación inicial y finalEvaluación de variables directasSe realiza la evaluación pretest con la anamnesis, el cuestionario sociodemográfico, el estudio antropométrico, la medida de la tensión arterial, el cuestionario de toxicidad del tratamiento, las escalas visuales analógicas del dolor y la incontinencia urinaria, el hábito previo al ejercicio físico a partir del cuestionario de Godin22, la prueba de esfuerzo submáximo del escalón correspondiente al test de fitness canadiense modificado (mCAFT)23 controlado con la frecuencia, la tensión arterial y la percepción subjetiva del esfuerzo con la escala de Borg CR-10. Se calcula la 1RM (Lander) estimada a partir del test de fuerza-resistencia del tronco y las extremidades inferiores, siguiendo el protocolo de la ASEP24. Se facilitan los cuestionarios de CDV y fatiga para ser autocompletados.
El registro de las variables antropométricas sigue el protocolo25 y corresponden al peso, el índice de masa corporal, el índice cintura cadera, el perímetro cintura, la suma de los siete pliegues cutáneos incluyendo (pectoral, axilar medio,tricipital, subescapular, abdominal, suprailíaco y muslo) y el porcentaje de masa grasa es estimada a partir de la fórmula de Jackson y Pollock26. Se formaliza la bioquímica completa procesada en el laboratorio central, evaluando los niveles de testosterona libre en sangre, lípidos en sangre incluyendo (colesterol total, lipoproteínas de alta y baja densidad en colesterol y triglicéridos) y niveles PSA.
La CDV se evalúa mediante la functional assessment cancer therapy scale-prostate (FACT-P, [rango: 0–156]) (4.a versión).
La fatiga se evalúa con la escala FACIT-escala de cansancio (rango: 0–52) (4.a versión).
La intensidad del síntoma de incontinencia se evalúa con la escala visual analógica categórica que incluye 4 categorías desde 0, no mojado, hasta 10, totalmente mojado.
La intensidad del dolor se evalúa a partir de la escala visual analógica numérica. La puntuación está numerada desde 0, no dolor, hasta 10, dolor insoportable.
La capacidad de fuerza-resistencia se estima a partir del número total de contracciones musculares completadas a una cadencia de 22 repeticiones/min marcadas por un metrónomo (metrónomo de Korg MA-30) programado a 44ppm con una carga liviana.
La fuerza submáxima muscular, se evalúa como el máximo peso que el participante puede levantar en 8 repeticiones consecutivas manteniendo una posición higiénica sin descompensarse. La carga a movilizar corresponde al 70% de la 8RM estimada con los resultados del test de fuerza-resistencia y a partir de la fórmula de Lander. El test incluye la evaluación de dos grupos musculares, uno localizado al tronco implicando la musculatura de pectoral y se realiza en el banco horizontal. El otro localizado en la extremidad inferior implicando la musculatura de muslo y pierna y se realiza en la prensa de pierna. La fuerza máxima muscular se calcula de forma indirecta hipotética del 8RM aplicando la fórmula de Lander, J27. Este valor permite calibrar la intensidad de trabajo a nivel individual y de acuerdo a los porcentajes programados.
El tejido graso visceral abdominal se evalúa con el CT-escáner.
En la semana 24 en el postest se evalúan las mismas variables excepto la anamnesis y el cuestionario sociodemográfico.
Evaluación de covariablesA continuación, mostramos como se evaluaron las covariables incluyendo el modelo integrado de adherencia, los síntomas relativos a la enfermedad y la unidad de observación molecular.
Con la anamnesis se concretan los síntomas secundarios relativos a la enfermedad y el tratamiento. Estos se triangulan con los síntomas registrados en la historia clínica. El diseño del programa de fuerza permite adaptarse de forma flexible al síntoma de la incontinencia urinaria. El resultado es la mejora la fuerza de retención activa y la coordinación de la musculatura estriada del plano profundo del suelo pélvico, supliendo la insuficiencia de los esfínteres dañados y transfiriendo en una mejora del control de la continencia.
El diseño del modelo de adherencia se construye a partir de los principales modelos vigentes. El modelo integrado contiene las variables identificadas en los estudios que correlacionan con el mantenimiento de la conducta de ejercicio. El modelo incluye una estrategia didáctica por fases, que fomenta la autonomía progresivamente, traspasando el control de la actividad del supervisor al participante. El objetivo es mantener de la conducta una vez finalizada la fase experimental. El apoyo contingente durante el programa permite reforzar las variables más debilitadas. Se destacan, la percepción de control y la autoeficacia. Para evaluar el resultado de las variables del modelo integrado se aplica el cuestionario de Godin22.
El diseño de la unidad de observación molecular evalúa los factores técnicos asociados a la ejecución de fuerza-resistencia. La observación garantiza la salud del participante disminuyendo el riesgo de lesión que conlleva el trabajo. Las categorías integradas en la unidad y evaluadas a partir de la escala Likert son: la postura corporal en reposo y en fase de contracción, la biomecánica de contracción, incluyendo la asociación respiratoria, la correcta consecución del programa, la transferencia del trabajo de fuerza en la calidad de los patrones motores básicos de la marcha y el ascenso-descenso del escalón (rango: 0–30). Finalmente, se incluyen las notas del observador. Se realiza una observación semanal registrada por el experimentador y una cámara de video. Se calcula la media correspondiente a la fase inicial del programa que incluye de la semana 1 a la 6 y la media del correspondiente a la fase autónoma de la semana 18 a la 24.
Cálculo del tamaño de la muestra y análisis estadísticoEl tamaño de la muestra calculada para detectar una diferencia entre grupos de 5,0 puntos es el resultado el test FACT-P (DE: 9). Se aplica el test de dos colas con un riesgo alfa del 5% y un riesgo beta del ,05. El número necesario de participantes es de 33. Para los datos apareados en las variables continuas que siguen una distribución normal, el test estadístico utilizado es la t de Student-Fisher con un número de grados de libertad de (n-1). Para las variables continuas que no siguen una distribución normal se utiliza el test no paramétrico para datos apareados de Wicolxon o U de Man Whitney. Para analizar las variables categóricas se utiliza el test de la χ2. Se ha diseñado un modelo multivariante con las dimensiones que integran el cuestionario de CDV. Se han estudiado las variables del modelo multivariante que resultan significativas y explican la variación del test de CDV a partir del análisis de regresión lineal múltiple. Los análisis estadísticos se realizan con el programa SPSS versión 15. El nivel de significación escogido es del 5%.
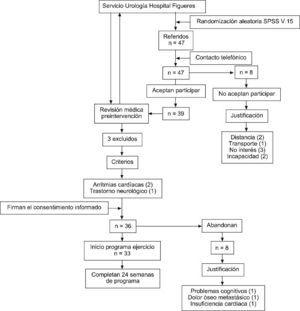
De los 46 sujetos referidos por el servicio de Urología del Hospital de Figueres, se construyó una muestra de 36 sujetos para participar en el estudio. La asistencia a las sesiones fue superior al 93% (30 de 32 sesiones). Durante la intervención 3 hombres abandonaron el programa por problemas cognitivos, dolor óseo metastático e insuficiencia cardiaca. El diagrama de flujo CONSORT representa el procedimiento de la muestra en el estudio (figura 1). Al finalizar la intervención, en la semana 24 se observa que un 100% de la muestra se ha adherido a la actividad influenciado por las variables de percepción de control, autoeficacia, identificación de la dosis terapéutica, por el control de los síntomas de incontinencia y dolor y, por la satisfacción que provoca. (figura 1 y tabla 1)
Figura 1. Diagrama de flujo CONSORT.
Tabla 1. Descripción de las características clínicas y epidemiológicas de los participantes
| Variable | Grupo intervención (n=33) |
| Edad (años) x ¯ (DE) (rango) | 71,78 (7,22) (55–83) |
| Peso (kg) x ¯ (DE) (rango) | 80,40 (11,60) (64,2–111,5) |
| IMC (kg/m2) x ¯ (DE) (rango) | 28,67 (2,99) (24,16 a 33,97) |
| Tensión Arterial (mm Hg) | |
| PAS x ¯ (DE) | 150,25 (21,31) |
| PAD x ¯ (DE) | 81,90 (11,03) |
| Frecuencia cardiaca reposo (latidos/min) (DE) | 74 (10,74) |
| Clasificación tumoral TNM n.o (%) | |
| Estadio i | 0 (0) |
| Estadio ii | 13 (39,39) |
| Estadio iii | 18 (54,54) |
| Estadio iv | 1 (3,03) |
| Desconocido | 1 (3,03) |
| PSA diagnóstico (ng/ml) x ¯ (DS) (rango) | 17,95 (24,32) (2,84–>100) |
| PSA inicio del programa (ng/ml) x ¯ (DE) (rango) | 0,55 (1,36) (0,01–5,5) |
| Tratamiento n.o (%) | |
| Quirúrgico (P) | 15 (45,45) |
| Hormonal (TDA) | 15 (45,45) |
| Combinado | |
| R+TDA | 1 (3,03) |
| P+TDA | 2 (6,06) |
| Cuestionario sociodemográfico | |
| Estado civil | |
| Casado/s | 30 (90,90) |
| Viudo/s | 2 (6,06) |
| Soltero/s | 1 (3,03) |
| Situación laboral | |
| Jubilado | 31 (93,93) |
| Activos | 2 (6,06) |
| Ejercicio aeróbico previo n.o (%) | |
| Cat 1≥3 veces por semana | 24 participantes (72,72%) |
| Intenso | 1 participante (3,03%) |
| Moderado | 11 participantes (33,33%) |
| Suave | 12 participantes (36,36%) |
| Cat 2<2 veces por semana | 9 participantes (27,27) |
| Intenso | |
| Moderado | 5 participantes (15,15%) |
| Suave | 4 participantes (12,12%) |
| Ejercicio de fuerza-resistencia previo n.o (%) | 0 (0) |
| ≥3 veces por semana | 0 (0) |
| <2 veces por semana | 0 (0) |
IMC: índice de masa corporal; P: prostatectomía; P+TDA: prostatectomía con terapia de privación androgénica; PAS: presión arterial sistólica; PAD: presión arterial diastólica; PSA: antigen prostático específico; R+TDA: radioterapia combinada con terapia de privación androgénica; TDA: terapia de privación androgénica.
El apartado de resultados se ha organizado atendiendo en primer lugar (apartados 1–7) a los resultados de las variables directas que son las antropométricas, cardiovasculares en reposo, eficacia cardiovascular en esfuerzo submáximo, presión arterial, fuerza muscular, CDV (FACT-P), incontinencia urinaria, fatiga y dolor. Los dos apartados siguientes se dedican a presentar la relación entre la incontinencia urinaria y la CDV (apartado 8) y el modelo multivariante de las dimensiones que integran el cuestionario de la CDV FACT-P (apartado 9). Por último, se presentan los resultados de la covariantes relativas a la adherencia al programa (apartado 10) y a la unidad de observación molecular (apartado 11).
Variables antropométricasLos resultados de las variables antropométricas determinan que el perfil del participante al inicio del programa es androide con una concentración de grasa a nivel abdominal. Al finalizar el programa se observa una disminución significativa en las medias y desviación típica (DT) de todas las variables excepto la del peso (tabla 2).
Tabla 2. Variables antropométricas
| Descripción del parámetro. | Pretest | Postest | Pretest-postesta | |||||
| Variables | (n) | x ¯ | DT | x ¯ | DT | x ¯ | DT | p* |
| Peso (kg) | 33 | 80,40 | 11,60 | 79,92 | 12,08 | ,478 | 1,89 | ,157 |
| IMC (kg/m2) | 33 | 28,67 | 2,99 | 28,20 | 3,06 | 0,46 | 1,02 | ,007* |
| ICC | 33 | 1,01 | 0,05 | 0,99 | 0,05 | 0,02 | 0,03 | ,003* |
| PC | 33 | 104,46 | 8,68 | 101,90 | 8,97 | 2,56 | 2,49 | ≤,001* |
| ∑7 pliegues (mm) | 33 | 219,76 | 44,17 | 180,30 | 37,10 | 39,46 | 31,09 | ≤,001* |
| MG-7 (%) | 33 | 40,87 | 15,18 | 28,96 | 11,42 | 11,90 | 10,59 | ≤,001 |
ICC: índice cintura cadera; IMC: índice de masa corporal; MG-7 (%): masa de grasa expresado en porcentaje; PC: perímetro cintura; ∑7 pliegues: suma de los siete pliegues corporales.
p*: valor de significación p<,05.
aCambios observados a las 24 semanas del programa de intervención.
Se observa una disminución significativa en cada uno de los siete pliegues corporales registrados. De todos ellos, los 2 pliegues que proporcionalmente disminuyen más se circunscriben en el área abdominal y corresponden concretamente al pliegue suprailíaco, con una diferencia de la media de 6,22 y el pliegue abdominal con una diferencia de la media 5,91. Mientras que, el pliegue que disminuye menos corresponde al pliegue pectoral 4,75.
Variables cardiovasculares de reposoLos parámetros cardiovasculares de reposo disminuyen de forma significativa después de la aplicación del programa (tabla 3). En la tabla 3, se especifican los cambios registrados en las variables de frecuencia cardiaca, presión arterial sistólica y presión arterial diastólica de reposo.
Tabla 3. Variables cardiovasculares de reposo
| Descripción del parámetro | Pretest | Postest | Pretest-postest a | |||||
| Variables | (n) | x ¯ | DT | x ¯ | DT | x ¯ | DT | p* |
| FC-R | 33 | 74,00 | 10’74 | 71,96 | 11,59 | 2,03 | 8,79 | ,02* |
| PAS-R | 33 | 150,25 | 21,31 | 139,96 | 18,65 | 10,28 | 16,16 | ,001* |
| PAD-R | 33 | 81,90 | 11’03 | 78,65 | 10,28 | 3,25 | 11,61 | ,062 |
FCR: frecuencia cardiaca de reposo (latidos/min); PAD-R: presión arterial diastólica de reposo (mmHg); PAS-R: presión arterial sistólica de reposo (mmHg).
p*: valor de significación p<,05.
a Cambios observados a las 24 semanas del programa de intervención.
Los parámetros cardiovasculares de esfuerzo disminuyen de forma significativa después de la aplicación del programa. La percepción subjetiva de esfuerzo del participante, también, disminuye de forma significativa. Además, la tensión arterial sistólica disminuye de forma significativa mientras que la tensión arterial diastólica lo hace de forma no significativa (tabla 4).
Tabla 4. Parámetros cardiovasculares en la prueba de esfuerzo submáximo. (mCAFT)
| Descripción del parámetro | Pretest | Postest | Pretest-postest a | |||||
| Variables | (n) | x ¯ | DT | x ¯ | DT | x ¯ | DT | p * |
| FCsubmàx | 24 | 122,83 | 16,98 | 115,58 | 19,51 | 7,25 | 19,42 | ,040 * |
| PASsubmàx | 24 | 180,58 | 22,29 | 172,79 | 25,81 | 7,79 | 20,66 | ,039 * |
| PADsubmàx | 24 | 90,16 | 14,96 | 83 | 9,95 | 7,16 | 16,88 | ,029 * |
| Borgsubmàx | 24 | 5,08 | 1,742 | 4,375 | 1,61 | ,70 | 1,6 | ,02 * |
| VO2 màx | 30 | 16,16 | 8,04 | 22,26 | 5,73 | 6,10 | 5,07 | <,001 * |
Borgsubmáx: escala de percepción subjetiva del esfuerzo de Borg submáximo; FCsubmáx: frecuencia cardiaca submáxima (latidos/min); PADsubmáx: presión arterial diastólica submàxima (mmHg); PASsubmáx: presión arterial sistólica submáxima (mmHg); VO2 máx: consumo máximo de oxígeno [ml kg−1 min−1].
* p: valor de significación p<,05.
a Cambios observados a las 24 semanas del programa de intervención
Según la categorización de la Joint Nacional Comitee (JNC)28, se observa una disminución del 50% de la hipertensión arterial (tabla 5).
Tabla 5. Variables de la presión arterial *
| Categorías | Presión arterial | Pretest (n=33) | Postest (n=33) | |||
| PAS/PAD (mmHg) | n | % | n | % | ||
| 1 | Óptima | <120/I <80 | 5 | 15,15 | 5 | 15,15 |
| 2 | Normal | 120–130/i 80–85 | 2 | 6,06 | 7 | 21,21 |
| 3 | Normal-alta | 130–139/i/o 85–89 | 2 | 6,06 | 9 | 27,27 |
| HTA | ||||||
| 4 | Estadio 1 | 140–159/i/o 90–99 | 5 | 15,15 | 3 | 9,09 |
| 5 | Estadio 2 | 160–179/i/o 100–109 | 2 | 6,06 | 0 | 0 |
| 6 | Estadio 3 | ≥180/i/o ≥110 | 0 | 0 | 0 | 0 |
| 7 | HSA | ≥140 /< 90 | 17 | 51,51 | 9 | 27,27 |
PAS: presión arterial sistólica; PAD: presión arterial diastólica; HSA: hipertensión sistólica aislada; HTA: hipertensión arterial; mmHg: milímetros de mercurio.
* Las variables especificadas corresponden a valores en reposo. Si la PAS o la PAD están en categorías diferentes, el intervalo recomendado es el menor indicado.
El porcentaje de aumento de las variables tanto de la resistencia muscular como la 8RM es superior en las extremidades inferiores que las superiores. En el grupo de pectoral, la fuerza-resistencia aumenta en un 57,83%, mientras que la 8RM aumenta el 22,76%. En la musculatura de la extremidad inferior la fuerza-resistencia aumenta en un 61,45% mientras que la 8RM aumenta el 45,49% (tabla 6).
Tabla 6. Cambios en las medias y la desviación típica (DT) de la fuerza muscular
| Descripción del parámetro | Pretest | Postest | Pretest-postest a | ||||||||
| Variables | Grupo | Rango | (n) | x ¯ | DT | x ¯ | DT | x ¯ | DT | p * | |
| Pretest | Postest | ||||||||||
| Rmusc | Pec | (2–23) | (7–42) | 31 | 12,83 | 5,20 | 20,25 | 7,87 | 7,41 | 6,97 | <,001 * |
| EI | (8–50) | (10–90] | 32 | 19,43 | 9,49 | 31,37 | 18,12 | 11,93 | 18,87 | <,001 * | |
| 8RM | Pec | (5,3–36,5) | (6,6–45,6) | 32 | 21,66 | 8,38 | 26,59 | 8,91 | 4,93 | 4,37 | <,001 * |
| EI | (6,6–135,4) | (10,7–159,6) | 32 | 57,59 | 35,19 | 83,79 | 43,33 | 26,19 | 24,78 | <,001 * | |
EI: extremidades inferiores; Pec: pectoral; 8RM: fuerza submáxima, calculada mediante las fórmulas de Lander (1) (20); Rmusc: resistencia muscular;
* p: valor de significación p<05. Se observa una mejora significativa de la fuerza-resistencia muscular y la fuerza submáxima. El efecto es mayor en las extremidades inferiores (Ver tabla 7 ). Fórmula de Lander (1985): carga levantada (kg)/(1,013–0,0267123 NR).
a Cambios observados a las 24 semanas del programa de intervención.
La media de la variable FACT-P aumenta de forma significativa al finalizar el programa de ejercicio físico (tabla 7).
Tabla 7. Cambios en la media y desviación típica (DT) de FACT-P
| Descripción del parámetro | Pretest | Postest | Diferencias relacionadas a | ||||||
| Cuestionario | Rango | n | x ¯ | DT | x ¯ | DT | x ¯ | DT | P * |
| FACT-P | (0–156) | 33 | 107,11 | 19,91 | 116,5 | 17,14 | 9,39 | 16,55 | ,003 * |
DT: desviación típica; FACT-P: cuestionario de calidad de vida del cáncer de próstata; x ¯ : media.
* p: valor de significación p<,05. Modelo multivariante de las dimensiones que integran el cuestionario de la calidad de vida FACT-P.
a Cambios observados a las 24 semanas del programa de intervención.
Con el programa fuerza se observa una disminución significativa del síntoma de incontinencia y dolor, mientras que la mejora de la fatiga no es significativa (tabla 8).
Tabla 8. Cambios en las medias y desviación típica de la incontinencia urinaria, la fatiga y el dolor
| Descripción del parámetro | Pretest | Postest | Diferencias relacionadas a | ||||||
| Cuestionario | Rango | (n) | x ¯ | DT | x ¯ | DT | x ¯ | DT | p * |
| EVA-IU | (0–10) | 33 | 3,79 | 2,54 | 1,03 | .918 | 2,75 | 1,88 | ,000 * |
| FACIT | (0–52) | 33 | 39,91 | 9,72 | 42,90 | 6,60 | 2,99 | 10,46 | ,110 |
| EVA- D | (0–10) | 33 | 4,57 | 2,41 | 2,66 | 1,79 | 1,90 | 1,25 | ≤,001 |
DT: desviación típica; EVA-IU: escala visual analógica de la incontinencia urinaria; EVA-D: escala visual analógica del dolor; FACIT: cuestionario de fatiga; x ¯ :media.
* p: valor de significación p<05.
a Cambios observados a las 24 semanas de programa de intervención.
Se categoriza la variable de la escala visual analógica categórica en dos grupos, correspondiente a uno, menos mejora en la incontinencia urinaria y 2, más mejora en la incontinencia urinaria. Se ha comparado el resultado del cuestionario de CDV (FACT-P) antes y después del programa con la variable mejora de la incontinencia urinaria. La media del cuestionario FACT-P en el grupo con más mejora de la incontinencia urinaria (x¯=14,75) es superior estadísticamente a la media (x¯=2,95) de los pacientes que tienen menos mejora de la IU (t de Student=2,15; p=,039) (tabla 9).
Tabla 9. Incontinencia urinaria
| Descripción del parámetro | Diferencias relacionadas | Prueba t por la igualdad de medias | ||||
| cuestionario | EVA-C | N | x ¯ | DT | t | p * |
| FACTP DIF * | 1 | (n=15) | 2,95 | 14,58 | −2,152 | ,039 |
| 2 | (n=18) | 14,75 | 16,50 | |||
* Diferencia en el resultado del cuestionario de calidad de vida, entre el valor final al acabar la intervención y el inicio de la intervención 1: menos mejora de la incontinencia urinaria; 2: más mejora de la incontinencia.
En el análisis de regresión lineal múltiple (tabla 10) se analizan las diferencias obtenidas entre el valor postintervención y el valor preintervención, tanto en el valor total del test de CDV como de cada una de las dimensiones. Además se considera el coeficiente β de cada variable independiente con el objetivo de interpretar el signo de forma que, si es positivo aumenta el valor de la variable y si es negativo disminuye. Las variables del modelo multivariante que resultan significativas y explican la variación en la puntuación del test de CDV son: El estado físico general de salud, el estado emocional y la dimensión de los síntomas relativos al cáncer de próstata. Las dimensiones no significativas son el ambiente familiar y social y la escala de fatiga. La r2=,933%.
Tabla 10. Regresión múltiple FACT
| Dimensiones cuestionario FACT | T | β | p* |
| 1.- PWB: estado físico general de salud | 2,528 | ,249 | ,018 |
| 2.- SWB: ambiente familiar y social | 1,170 | ,122 | ,252 |
| 3.- EWB: estado emocional | 3,769 | ,404 | ,001 |
| 4.- PCS: otras preocupaciones | 3,909 | ,365 | .001 |
| 5.- FACIT: escala de fatiga | −3,19 | −,028 | ,752 |
| r2=,933% |
Manteniendo las variables significativas del modelo conseguimos los nuevos coeficientes, que son los siguientes. (tabla 11)
Tabla 11. Coeficientes FACT
| Dimensiones cuestionario FACT-P | T | β | p * |
| 1.- PWB: estado físico general de salud. | 3,32 | ,285 | ,002 |
| 3.- EWB: estado emocional. | 4,54 | ,419 | ,000 |
| 4.- PCS * : síntomas. | 4,56 | ,404 | .000 |
* PCS: en el cuestionario de Calidad de vida corresponde a Otras preocupaciones, atribuido a los síntomas relativos a la enfermedad y al tratamiento.
Se observa un 100% de adherencia a la actividad. Los resultados demuestran que los participantes mantienen la conducta autónoma de ejercicio por la percepción de mejora en el síntoma de incontinencia y el dolor, además del bienestar general postentrenamiento. Las variables de percepción de control, autoeficacia y fuerza de voluntad son decisivas para el mantenimiento a largo término. Dos variables no incluidas al modelo que deben ser consideradas de nueva entrada son el conocimiento de la dosis terapéutica y la distracción psicosocial durante la actividad.
Unidad de Observación MolecularLa media registrada del grupo en la fase inicial semana 1–6, la puntuación media es de 12,5 puntos, mientras que el resultado de la fase autónoma 18–24 es de 24 puntos. En el campo de observaciones en la fase final se destaca la mejora en la calidad de los patrones motores básicos, destacando la coordinación en el ascenso y descenso del escalón en el test aeróbico submáximo mCAFT
DiscusiónLos resultados demuestran que el ejercicio de fuerza resistencia mejora significativamente la CDV del enfermo de cáncer de próstata. El resultado viene mediado por la mejora de la dimensión física, incluyendo el dolor, la dimensión funcional, incluyendo la incontinencia urinaria y la dimensión emocional del cuestionario de CDV.
La mejora registrada en las variables de fuerza submáxima y fuerza-resistencia es clara. Coincidimos con Latham17, al observar que el aumento de fuerza tiene un efecto de retroacción positiva, de forma que revierte y transfiere en la (capacidad, ejecución técnica y calidad) de los patrones motores básicos de la marcha y el ascenso-descenso del escalón. Este resultado se confirma tanto con el análisis de los cambios identificados en los registros periódicos de la unidad de observación molecular como en los resultados del test submáximo aeróbico mCAFT.
En relación a la fuerza-resistencia la mejora registrada es superior a la fuerza-submáxima. En ambas variables, el incremento es superior en las extremidades inferiores que en el tronco. Se ha de considerar que la pérdida fisiológica natural de fuerza en las personas mayores es anterior en las extremidades inferiores a la pérdida en las extremidades superiores. Además, el aumento de la fuerza extensora de las extremidades inferiores correlaciona con el aumento de la velocidad de la marcha, capacidad de propiocepción y reequilibrio29. Este efecto reduce el riesgo de caída y fractura. A nivel general mejora la CDV de la persona mayor30.
En relación a la capacidad de fuerza su incremento correlaciona con el freno del proceso catabólico del sistema muscular, mejora el estado de sarcopenia que se agrava y perpetúa con la enfermedad del cáncer. La recuperación tanto de la masa muscular como la intensidad y calidad de contracción muscular genera un arco de movimiento eficaz. Estos factores concretos determinan la mejora general de la funcionalidad, en la habilidad y en el movimiento que exigen las actividades de la vida diaria, retardando la manifestación de fatiga y mejorando la salud percibida de las personas mayores31,32,33.
La edad y el tratamiento hormonal son factores que provocan una pérdida acelerada de la densidad mineral ósea34. A este respecto el programa de fuerza es idóneo para frenar el proceso de osteoporosis y el riesgo asociado a la fractura ya que aumenta la densidad mineral ósea y mejora la porosidad y solidez del hueso35. Los resultados de los estudios describen una relación directamente proporcional entre el trabajo de fuerza muscular y la densidad mineral ósea. Este efecto también se identifica en personas mayores, aunque la magnitud del cambio depende del estado inicial de la estructura32.
En contrapartida, el trabajo de fuerza en personas mayores tiene un mayor riesgo de sufrir lesiones de las partes blandas, principalmente en las inserciones tendinosas36. Este riesgo aumenta en el subgrupo de personas enfermas, lo que justifica la importancia de calibrar la dosis de trabajo eficaz para conseguir el máximo beneficio en la estructura ósea y muscular, minimizando el riesgo de lesión.
Los estudios revisados estiman que la duración mínima del programa de fuerza para conseguir el aumento de la densidad mineral ósea es de 24 semanas37. La gestión de este parámetro concuerda con el diseño de nuestro programa, superando una de las limitaciones metodológicas identificadas en otros programas similares10. Los resultados observados justifican el efecto del trabajo de fuerza sobre la salud ósea, aunque no se debe olvidar la promoción de la correcta alimentación con ingesta de calcio38.
La disminución de la capacidad músculo-esquelética y, sobre todo, en las extremidades inferiores correlaciona con la tríada caída, fractura y dependencia de la persona mayor. Este riesgo aumenta enormemente en la persona frágil39,40. El impacto resultante de la caída sobre el hueso osteoporótico, habitualmente causa una fractura, con la consecuente pérdida de movilidad y con el riesgo de generar el síndrome poscaída como consecuencia una situación de dependencia funcional41. A partir del entrenamiento de fuerza programado se observa un efecto inicial de condicionamiento muscular y posteriormente un aumento de la salud ósea. La mejora osteomuscular permite a la persona mayor mantener la autonomía retardando el riesgo de situarse en la zona umbral de dependencia que habitualmente provoca la enfermedad y el tratamiento de cáncer42,43,44.
La descompensación antropométrica, metabólica y cardiovascular es habitual entre los hombres de cáncer de próstata. Este efecto está provocado por el déficit de secreción de testosterona. El fenotipo pretest del participante corresponde a la tipología II (androide). El exceso de grasa en la zona abdominal se identifica a partir de las variables del perímetro cintura, el índice cintura cadera y la muestra de los dos pliegues de mayor espesor, el suprailíaco y abdominal. El depósito graso intrabdominal correlaciona directamente con los factores de riesgo cardiovascular. Si esta situación se mantiene y no revierte es un factor de riesgo de morbimortalidad45.
Con el objetivo de disminuir la obesidad, el ejercicio recomendado por las organizaciones es de tipo aeróbico ACSM (1998). Los resultados de este estudio demuestran que el ejercicio de fuerza-resistencia es una forma eficaz para mejorar la calidad de los tejidos. Los resultados confirman la disminución significativa de las variables antropométricas del IMC, el perímetro cintura, el índice cintura cadera, la suma de los siete pliegues cutáneos y el porcentaje de masa grasa. Este resultado podría correlacionar con la mejora registrada en la eficacia cardiovascular detectado a partir de la disminución de las variables: frecuencia cardiaca, tensión arterial, percepción subjetiva al esfuerzo tanto en situación de reposo en esfuerzo submáximo, aunque la magnitud de la relación no queda bien definida. En el postest mejora la capacidad de trabajar a una intensidad de esfuerzo mayor con una recuperación cardiovascular postesfuerzo más eficaz. Se registra un descenso gradual de la tensión arterial que es evidente y significativo a partir de la sexta semana del programa. Al finalizar la fase experimental el subgrupo de personas hipertensas se reduce el 50% mediado por el descenso de la presión arterial sistólica. De acuerdo con los resultados se confirma que el programa tiene un efecto hipotensor significativo en la presión arterial sistólica del subgrupo de hombres hipertensos46 aunque no podemos confirmar que el efecto se mantenga a largo término. La mejora registrada en la respuesta cardiovascular del enfermo de cáncer de próstata corrobora el principio de relación entre capacidades. En este sentido, la mejora en la capacidad de fuerza detectada con las variables fuerza-resistencia y fuerza-submáxima generan la adaptación en la capacidad aeróbica registrada con las variables de eficacia cardiovascular en estado de reposo y en situación de esfuerzo submáximo mCAFT. El comportamiento de las variables evidencia una disminución del estrés cardiovascular con un mayor trabajo resultante y una menor percepción subjetiva del esfuerzo. Se deben realizar más estudios en esta línea para cuantificar la relación entre la dosis exacta de actividad de fuerza y su efecto en la salud cardiovascular.
La mejora del perfil antropométrico y la respuesta cardiovascular descritos en el parágrafo anterior son determinantes en la mejora de los factores interrelacionados con el síndrome metabólico. Este efecto se identifica con el análisis conjunto derivado de la disminución de las variables del perfil de lípidos en sangre, tensión arterial de reposo y en actividad, reducción de la obesidad abdominal y mejora de la glucemia, lo que implica una mayor sensibilidad a la insulina47. Estos resultados coinciden con los de Warburton y confirman la mejora del síndrome metabólico correlaciona con la mejora de la dimensión funcional y la CDV de la persona mayor32.
Por otro lado, el programa consigue disminuir, controlar y revertir los síntomas de incontinencia, fatiga y dolor. El efecto se consigue por la capacidad que ofrece el programa de adaptación flexible a los síntomas más habituales asociados a la enfermedad y sus tratamientos. Por ejemplo, considerando el síntoma de incontinencia, el programa de fuerza incluye la gestión de tres fases consecutivas correspondientes a la sensopercepción del suelo pélvico, el reforzamiento y finalmente los ejercicios de desbordamiento irradiados desde la musculatura sana hacia la musculatura atrofiada y dañada del suelo pélvico. Este modelo organizado por fases y adaptado al síntoma de incontinencia consigue mejorar de forma significativa la CDV del subgrupo de participantes afectados de incontinencia urinaria con un resultado mayor comparado con el subgrupo de enfermos no afectados o con los resultados de programas similares que no tienen la capacidad de adaptarse a los síntomas48. Los mecanismos concretos que median la mejora son los de conciencia y el control de la continencia. Este efecto podría incidir en la mejora del resto de dimensiones que integran el cuestionario de CDV, por ejemplo la recuperación de la red social.
La American Society of Clinical Oncology (2008), confirma que la CDV es un indicador fuerte e independiente de la supervivencia en el cáncer. En este estudio, el comportamiento de las dimensiones que integran el cuestionario de CDV, que mejoran de forma significativa, son la capacidad de funcionamiento personal, el bienestar emocional y la dimensión que incluye los síntomas relativos a la enfermedad (incontinencia, dolor y fatiga). Desde la fase inicial del programa se ha realizado el estudio contextualizado para la promoción multidisciplinar de las variables que correlacionan con la adherencia. Considerando la piedra angular del estudio las personas mayores afectadas de cáncer de próstata y su entorno sociofamiliar. Este constructo no entiende a la adherencia exclusivamente como un valor final como índice del valor del estudio. Sino que en la fase experimental se ha ofrecido el apoyo contingente requerido en relación a las variables más débiles relativas a la percepción de control, la autoeficacia y la percepción de mejora. Esta consideración ha favorecido el mantenimiento autónomo de la actividad una vez finalizada la fase experimental, consiguiendo una adherencia del 100% de la muestra. Como variables significativas de nueva entrada que se deben integrar al modelo corresponden al conocimiento de la dosis terapéutica y la distracción psicosocial.
Al considerar globalmente los resultados abrimos la controversia sobre la eficacia del screening y diagnóstico del cáncer de próstata a partir del test del PSA en el cribaje poblacional. También nos planteamos la cuestión sobre la necesidad de tratamiento del cáncer de próstata de bajo riesgo. Esta afirmación se justifica por el encadenamiento de factores de riesgo observados de forma conjunta o secuencial que determinan el síndrome metabólico del hombre mayor tratado de cáncer de próstata. En este estudio identificamos el perfil graso, la hipertensión arterial (con hipertensión sistólica aislada), la frecuencia cardiaca de reposo elevada, el colesterol, el valor elevado de lipoproteínas de alta densidad, la dieta excesiva en grasas saturadas, conducta sedentaria. La combinación de estos factores eleva el riesgo de enfermedad cardiovacular49. Si a este perfil además le añadimos los efectos secundarios propios de la enfermedad y sus tratamientos como, la incontinencia urinaria, disfunción e impotencia sexual, la fatiga, el distrés, aislamiento social, etc. podemos determinar que el impacto del tratamiento del cáncer de próstata en la CDV del enfermo es superior al que generaría la enfermedad. Concluimos el apartado con la cita de Traish, la identificación de estos factores confirma la cara oscura, silenciosa y desconocida del tratamiento de privación androgénica50.
Conclusiones• El programa de fuerza-resistencia resulta una intervención natural, no invasiva, económica y eficaz que complementa la atención sociosanitaria.
• La descompensación metabólica mantenida supone un alto riesgo de patología cardiovascular. Esta situación se agrava con el tratamiento de la enfermedad impactando tanto en la expectativa como en la CDV del enfermo. En este marco se justifican iniciativas sanitarias proactivas para disminuir los efectos secundarios y los riesgos que ocasionan los tratamientos de cáncer y mejorar la capacidad física y funcional revirtiendo en el estado de salud general del enfermo.
• A partir del programa de fuerza programado mejora la capacidad de fuerza-resistencia y la fuerza submáxima. La mejora general de la fuerza es superior en las extremidades inferiores que en el tronco. Se observa una transferencia de la fuerza en la capacidad aeróbica y en la habilidad de los patrones motores básicos. La mejora de la dimensión funcional retroalimenta el resto de dimensiones de la CDV.
• El programa consigue disminuir el riesgo cardiovascular mediado por la disminución de las variables antropométricas y sobretodo por la disminución del porcentaje de tejido graso especialmente en la zona abdominal y la disminución de la tensión arterial.
• El programa tiene un efecto hipotensor más evidente en la población hipertensa. Este efecto es significativo en la presión arterial sistólica y a partir de la sexta semana de programa.
• Los resultados justifican la capacidad de adaptación flexible del programa a los síntomas de incontinencia urinaria, fatiga y dolor. La disminución de la intensidad de los síntomas median la mejora de la dimensión psicológica y social del enfermo.
• Se identifica una mejora de las variables cardiovasculares de reposo, en esfuerzo submáximo y en la percepción subjetiva de esfuerzo.
• En virtud de los resultados se confirma que el programa de fuerza-resistencia es válido, sostenible y es la mejor forma de intervención destinada al hombre mayor afectado de cáncer de próstata. Este tipo de programa permite el control directo de las constantes vitales, disminuye el riesgo de disfunción cardiovascular, disnea y caída. Además, permite la atención inmediata en caso de urgencia.
Los autores declaran no tener ningún conflicto de intereses.
Recibido 30 Noviembre 2009
Aceptado 7 Enero 2010
Autor para correspondencia. bernat.serda@udg.edu