L’objectiu d’aquest estudi fou investigar la resposta a l’entrenament de resistència de l’expressió de l’ARNm del GLUT4 dels músculs soli i gastrocnemi en ratolins obesos. En aquest estudi es van utilitzar 40 ratolins mascles C57BL/6. Vuit ratolins (base normal [BN]) serviren com a controls no obesos i no entrenats, i 32 ratolins foren sotmesos a una dieta alta en greixos (DAG) (augment del 60% de kcal) durant 12 setmanes. A la setmana 16 els ratolins obesos foren distribuïts aleatòriament en els grups de tractament següents (n = 8 cada grup): obesos base (OB); baixa intensitat (BI); alta intensitat (AI), o grups de control d’obesitat (CO). BI i AI foren entrenats 5 dies per setmana durant 12 setmanes en una cinta de córrer motoritzada a 15 m/min amb un pendent del 5% (en BI) i/o en 22 m/ min en un pendent del 5% (en AI). Els ratolins CO es mantingueren sedentaris a la gàbia durant el programa d’entrenament. Es mesurà l’expressió de l’ARNm del GLUT4 dels músculs gastrocnemi i soli, utilitzant el mètode PCR en temps real. L’expressió de l’ARNm del GLUT4 del múscul soli en el grup BI augmentà aproximadament 2,2 vegades, enfront a 1,6 vegades en el gastrocnemi (p < 0,05). A més, l’expressió de l’ARNm del GLUT4 en els músculs soli i gastrocnemi dels grups BI i AI fou significativament major que en OB i en els grups CO (p < 0,05). Podem concloure que tota alteració de l’equilibri energètic del cos, especialment per l’entrenament físic i/o una dieta alta en greixos, pot influir en els mecanismes moleculars i cel·lulars que actuen per establir una homeòstasi estable.
The aim of this study was to investigate the expression of GLUT4 mRNA in soleus and gastrocnemius muscles in obese mice in response to endurance training. Forty male C57BL/6 mice were used in this study. Eight mice (normal base [NB]) served as non-obese non-trained controls, and 32 mice were put on a high fat diet (HFD) regimen (60% kcal fat) for 12 weeks. At week 16, the obese mice were randomized into the following treatment groups (n = 8 each group): obese base [OB]; low intensity [LI]; high intensity [HI], or obese control [OC] groups. LI and HI trained for 5 days/week for 12 weeks on a motorized treadmill at 15 m/min on a 5% slope (for LI), and/or at 22 m/min on a 5% slope (for HI). OC mice were kept sedentarily in the cage during the training program. GLUT4 mRNA expression was measured in gastrocnemius and soleus muscles using a Real Time-PCR method. GLUT4 mRNA expression of soleus muscle in LI group increased about 2.2 fold, against about 1.6 fold for gastrocnemius (P < .05). In addition, GLUT4 mRNA expression of soleus and gastrocnemius muscles in LI and HI groups were significantly higher than OB and OC groups (P < .05). It can be concluded that any disturbance in body energy balance, especially by exercise training and/or high fat diet, can influence these molecular and cellular mechanisms that act to establish a stable homeostasis.
Introducció
Generalment s’admet que l’obesitat està fonamentalment associada a una alteració de la taxa d’absorció de glucosa estimulada per la insulina en el múscul esquelètic, que s’ha atribuït a la resistència a la insulina. Diversos estudis s’han centrat en el sistema de transport de la glucosa com a part dels mecanismes subjacents. La glucosa transporta les cèllules del múscul esquelètic a través de les proteïnes transportadores de glucosa GLUT1 i GLUT41. Sembla que la isoforma GLUT1 és la transportadora de la glucosa que suporta el transport de la glucosa basal2,3, mentre que la isoforma GLUT4 augmenta el transport de glucosa en resposta a la insulina i a la contracció. La insulina i les contraccions transporten el GLUT4 de la reserva intracel·lular a la membrana plasmàtica i als túbuls T4,5.
Se sap que en els rosegadors, la capacitat d’absorció de la glucosa és major en els músculs oxidatius vermells que en els músculs glucolítics blancs6-10. Sembla que un mecanisme subjacent té un major nivell d’expressió de GLUT4, tant a nivell intracel·lular6,7 com a la membrana plasmàtica8. En el múscul esquelètic humà, la captació de glucosa s’associa positivament a la proporció de fibres de tipus i i negativament a la proporció de fibres de tipus iib11. Aquests resultats es basen en l’estudi in vitro de Zierath et al.12, que reportaren que l’augment d’insulina estimulada en la captació de la glucosa per damunt del nivell basal correlaciona estretament, tant afirmativament amb el percentatge de fibres musculars de tipus i, com negativament amb el percentatge de fibres tipus iia. Tanmateix, s’han reportat resultats poc convincents respecte a la relació entre la distribució del tipus de fibra i el contingut de GLUT4 en el múscul humà13-15.
Andersen et al.13 no trobaren cap correlació entre tipus de fibra i contingut de GLUT4, mentre que Houmard et al.15 mostraren una baixa correlació entre tipus de composició de la fibra i contingut de GLUT4.
Ha estat demostrat que els diferents músculs presenten importants diferències de contingut de GLUT4, i aquestes diferències sovint estan associades a les diferències en la captació de la glucosa estimulada per la insulina16,17. Com que el diferents músculs es composen d’una combinació de diferents tipus de fibres musculars18, és possible que hi hagi diferències significatives en el contingut de GLUT4 entre músculs.
Probablement, les diferències en el contingut de GLUT4 i la captació de la glucosa estimulada per la insulina estan relacionades amb el nivell d’entrenament. Els canvis de nivell d’activitat del múscul esquelètic són la clau reguladora del contingut de GLUT4 en ratolins19,20. Entre els humans, els esportistes tenen més GLUT4 que els subjectes control de la mateixa edat no entrenats21,22, i en ambdós, subjectes control normals i sans i individus amb la captació disminuïda de la glucosa estimulada per la insulina, l’entrenament físic ha demostrat que incrementa el contingut de GLUT420,23,24. A més, una disminució del nivell d’activitat pot minorar el contingut de GLUT420,25. Finalment, s’ha demostrat que canvis en l’activitat física i el contingut de GLUT4 estan relacionats amb canvis en la captació de la glucosa estimulada per la insulina20.
El principal objectiu d’aquest treball fou investigar l’expressió de l’ARNm del GLUT4 en el soli (múscul predominantment de contracció lenta) i el gastrocnemi (múscul predominantment de contracció ràpida) com a resposta a l’entrenament de resistència en ratolins obesos.
Subjectes i mètodes
Animals
En aquest estudi s’utilitzaren 40 ratolins mascles C57BL/6 (de 4 setmanes). Vuit ratolins no obesos (base normal [BN]; dieta estàndard alimentats ad libitum) van servir de control no obesos no entrenats (el grup BN es considerà com a valor de referència per calcular l’expressió gènica en temps real que s’expressa com a valors relatius) i 32 ratolins van ser sotmesos a una dieta alimentària rica en greixos (DAG) durant 12 setmanes que consistí en accés lliure a una dieta rica en greixos de 60% kcal (High-Fat Diet, Razi Vaccine & Serum Research Institute, Iran). A la setmana 16, els ratolins obesos foren assignats aleatòriament als grups de tractament següents (n = 8 cada grup): 1) grup obès base [OB]; 2) grup de baixa intensitat [BI]; 3) grup d’alta intensitat [AI], o 4) grup control obès [CO]. Els ratolins OB moriren abans del programa d’entrenament. BI i AI entrenaren 5 dies per setmana durant 12 setmanes en una cinta de córrer motoritzada. Els CO serviren de control no entrenats. Tots els ratolins van ser ficats en gàbies binàries, la temperatura de la sala dels animals es mantingué a 22 °C i es creà un cicle artificial de 12 h de llum i 12 h de foscor. S’aplicà un període de familiarització de 2 setmanes en què els ratolins corrien 7-10 m durant 10-15 min en un pendent del 5%. Després, es continuà l’entrenament a les 12 setmanes següents, durant 60 min, de forma contínua a 15 m/min en un pendent del 5% (els BI) i/o 41 min contínuament a 22 m/min en un pendent del 5% (els AI). El treball diari total es féu coincidir en ambdós grups i es fixà en 900 m la distància de carrera. Els ratolins CO es mantingueren sedentaris a la gàbia durant el programa d’entrenament. El pes es registrà setmanalment. BI, AI i CO van ser morts al final del programa d’entrenament. Se’ls retirà el menjar 12-14 h abans de morir. Els experiments van ser aprovats pel Comitè d’ètica d’investigació.
Preparació del múscul
Els ratolins van ser anestesiats per via intraperitoneal amb una preparació de ketamina (30-50 mg/kg en perfusió contínua [pc]) i xilacina (3-5 mg/kg pc) i moriren per extracció de sang del cor per prendre mostres del múscul 48 h després de la darrera sessió d’exercici, i es van dissecar els músculs soli i gastrocnemi. Les mostres de múscul es congelaren ràpidament en nitrogen líquid i es conservaren a −80 °C. Els procediments de preparació dels teixits i l’extracció d’ARN total estan a bastament descrits en diversos estudis26.
PCR en temps real
S’utilitzà ARN transcriptasa inversa o retrotranscripció i encebadors d’hexàmers aleatoris segons les instruccions del fabricant (AccuPower Green Star qPCR PreMix, BiONEER, Daejeon, Corea). Després, s’hi afegiren PCR Master Mix que contenien encebadors específics, ADN Taq Hotstar polimerasa i tampó de SYBR-Green PCR. Totes les mostres foren determinades per duplicat, i per a un control negatiu s’utilitzà la mateixa configuració, tret de l’addició de la transcriptasa inversa. No es detectà cap producte de PCR en aquestes darreres condicions.
Els nivells d’ARNm de GLUT4 i β-actina, un gen de manteniment, es determinaren per transcripció inversa quantitativa-PCR de l’ARN cel·lular total amb l’encebador directe 5´CCG CGG CCT CCT ATG AGA TAC T3´ i l’encebador revers 5´AGG CAC CCC GAA GAT GAG T3´ per a l’amplificació de l’ARNm del GLUT4 i l’encebador directe 5´ ACA ATG AGC TGC GTG TGG CC 3´i l’encebador revers 5´CCT CGT AGA TGG GCA CAG TG 3´per a l’amplificació de β-actina ARNm. Els productes d’amplificació van ser sotmesos a electroforesi en gels d’agarosa al 2% i es van tenyir amb bromur d’etidi.
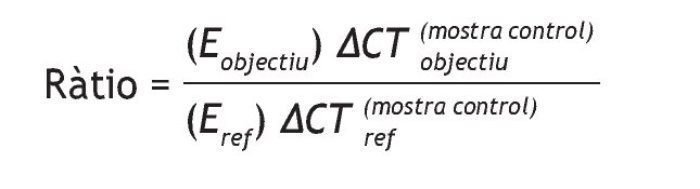
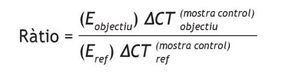
La quantificació en temps real de GLUT4 a β-actina d’ARNm es realitzà mitjançant un assaig de PCR SYBR-Green (Rotor-gene 6000, Corbett). GLUT4 ARNm i β-actina d’ARNm foren amplificats en tubs separats i el protocol de ciclat tèrmic de 40 cicles consistí en la desnaturalització a 95 °C durant 20 s, hibridació a 60 °C durant 60 s, extensió a 72 °C durant 30 s que s’inicià amb una desnaturalització inicial a 95 °C durant 15 min i es completà amb una extensió final a 72 °C durant 10 min. Durant l’etapa d’extensió, l’augment de la fluorescència fou mesurat en temps real. Les dades van ser obtingudes com a valors CT (valor del cicle llindar). L’expressió gènica relativa fou calculada amb la fórmula de Pfaffl27:
Anàlisi de dades
Els valors es presenten com a mitjana ± DE. S’utilitzà l’anàlisi de variància (ANOVA) d’una via seguit del test Honestly-significant-difference (HSD) de Tukey per a avaluar els efectes de l’entrenament sobre l’expressió relativa d’ARNm de GLUT4 en diferents grups. També s’utilitzà la prova t aparellada, per valorar la diferència entre l’ARNm del GLUT4 dels músculs soli i gastrocnemi de cada grup. En tots els tests s’utilitzà el programari SPSS 21.0 (SPSS Inc., Chicago, IL, EUA), i el valor de significació estadística s’establí en p ≤ 0,05.
Resultats
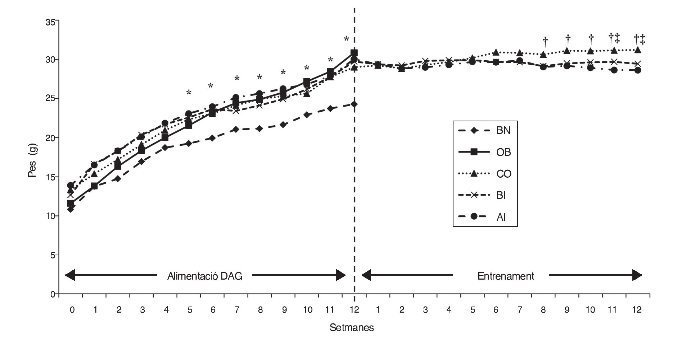
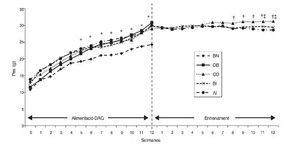
A la figura 1 es presenta la mitjana del valors del pes dels ratolins dels diferents grups durant la dieta alta en greixos (DAG) i les fases d’entrenament. El pes dels grups que consumiren DAG (és a dir, OB, CO, BI i AI) augmentà significativament en comparació amb BN a partir de la cinquena setmana durant la fase DAG que es mantingué alta fins a la setmana 12 (p ≤ 0,05). L’augment de pes dels 4 grups tractats fou del 18% de mitjana en comparació amb BN, que assolí el 32% a la dotzena setmana (fig. 1).
Figura 1 Canvi de pes de ratolins durant les fases d’alimentació DAG i d’entrenament. *: diferència significativa entre els grups obesos i normal; †: diferència significativa entre grups d’entrenament i OB; ‡: diferències significatives entre els grups AI/BI. AI: entrenament a alta intensitat; BI: entrenament a baixa intensitat; BN: base normal; CO: control obesos; OB: obesos base.
Durant la fase d’entrenament només s’estudiaren els grups d’entrenament (BI i AI) i CO, i la pèrdua de pes dels grups d’entrenament començà a diferenciar-se del grup CO des de la sisena setmana, i esdevingué significativa a partir de la vuitena setmana (p ≤ 0,05). Per tant, la pèrdua de pes en els grups d’entrenament (en comparació amb el grup CO) fou del 5 i del 7% en la sisena i dotzena setmana de la fase d’entrenament, respectivament. És interessant assenyalar que la diferència de la pèrdua de pes entre BI i AI aparegué a partir de la setmana 9 i arribà a ser estadísticament divergent a les setmanes 11 i 12 (p ≤ 0,05). De fet, la ràtio de la pèrdua de pes fou major en AI que en BI, de manera que els canvis en el percentatge de pes al final de l’entrenament de 12 setmanes del grup AI fou 8% vs 5,5% del grup BI.
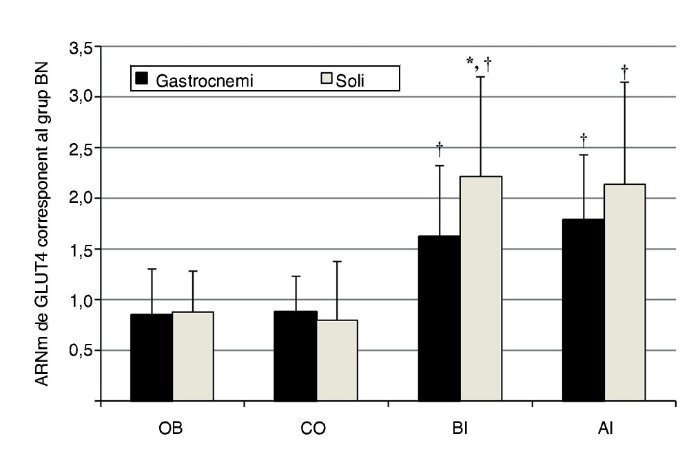
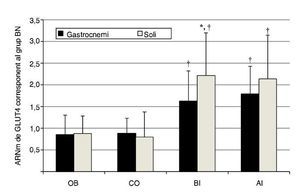
L’expressió de l’ARNm del GLUT4 del múscul soli en els ratolins que participaren en el grup BI augmentà aproximadament 2,2 vegades, enfront a ~ 1,6 vegades en el gastrocnemi, en relació a BN (p = 0,05); de manera similar, respecte a l’expressió de l’ARNm del GLUT4 incrementà, tot i que, estadísticament, de manera no significativa, per la pràctica d’exercici d’alta intensitat en els músculs soli i gastrocnemi ~ 2,1 i ~ 1,8 vegades, respectivament (p ≤ 0,05). A més, l’expressió d’ARNm del GLUT4 dels músculs soli i gastrocnemi en els grups BI i AI fou significativament major que en els grups OB i CO (p ≤ 0,05), amb una lleugera regulació en descens (down regulation) en els darrers grups (fig. 2).
Figura 2 Contingut d’ARNm de GLUT4 dels grups experimentals gastrocnemi i soli en relació amb el múscul emparellat en el grup BN (p ≤ 0,05). *: augment significatiu amb relació a BN; †: diferència significativa en comparació amb OB i CO (p ≤ 0,05).
Discussió
Ploug et al.28 establiren que GLUT4 en fibres no estimulades (per la insulina) es distribuïa al llarg de totes les fibres musculars, i era present tant en la superfície (68% del GLUT4 total) com en el nucli (32% del GLUT4 total) de les fibres. També trobaren que els nuclis eren desplaçats i alineats amb els vasos sanguinis que cursen al llarg de la superfície de la fibra, que ocasionen una gran fracció de GLUT4 prop de la font de la glucosa evitant la necessitat de difusió a través de llargues distàncies. Està ben documentat que, en estat normal, el GLUT4 circula lentament entre la membrana plasmàtica i un o més compartiments intracel·lulars, amb la gran majoria de transportadors que resideixen en els compartiments vesiculars dins de l’interior de la cèl·lula28,29.
L’acumulació d’insulina estimulada de la proteïna GLUT4 en la superfície de la cèl·lula pot ser causada per un increment de 10 a 20 vegades de la ràtio d’exocitosi amb una petita disminució (2-3 vegades) de la ràtio d’endocitosi del GLUT410,45,30.
La insulina estimula el transport de glucosa a través de la translocació de GLUT4 a partir de l’agrupació d’emmagatzemament intracel·lular cap a la membrana plasmàtica. La resistència a la insulina causada per la manca d’insulina o uns resultats anormals de senyalització de la insulina amb un descens en l’expressió y translocació de GLUT4 causen la hiperglucèmia i la diabetis30-32. També s’ha demostrat que la contracció muscular augmenta el contingut de GLUT4 de la membrana cel·lular29,30. Diversos estudis suggereixen que l’exercici físic causa l’expressió de la proteïna GLUT4 i la translocació en membrana plasmàtica mitjançant un mecanisme diferent de senyalització de la insulina5,33. La majoria d’estudis sobre el múscul esquelètic dels ratolins indiquen que hi ha més GLUT4 en les fibres de tipus i que en les del II10,34, la qual cosa coincideix amb els resultats que vam trobar en el ratolins. En aquest estudi només vam utilitzar el múscul soli, generalment conegut com a múscul de fibres de tipus I.
El nostre estudi concorda amb altres35-39 que han indicat que l’exercici físic incrementa l’expressió de la proteïna GLUT4 en subjectes diabètics, tal com succeí en els nostres subjectes obesos.
Vam veure que l’expressió d’ARNm de GLUT4 s’incrementa amb 12 setmanes d’entrenament de resistència, en ambdós músculs, en el soli (múscul en què predominen les fibres de contracció lenta) i en el gastrocnemi (en què predominen les fibres de contracció ràpida) en ratolins obesos, amb patró intens de dependència. Això significa que la intensitat de l’exercici pot afectar l’expressió del gen GLUT4 (i, probablement, la proteïna) en resposta a l’entrenament, la qual cosa pot provocar canvis metabòlics significatius especialment en els casos obesos. En consonància amb els nostres resultats, s’ha demostrat que la proteïna GLUT4 i el transport de glucosa són immensament superiors en les fibres musculars oxidatives vermelles (tipus I i IIa) que en les fibres glucolítiques blanques (tipus IIb)10,40. Això podria ser un factor important en l’adaptació a l’exercici, degut a què els resultats de l’entrenament de resistència faciliten un canvi de fibres de tipus iib a fibres tipus IIa41. Tanmateix, en els músculs esquelètics humans hi ha una diferència molt menor en l’expressió de GLUT4 en diferents tipus de fibres musculars34,42. Daugaard et al.34 van aïllar fibres musculars individuals i les van classificar segons la isoforma de la miosina. GLUT4 fou ∼ 20% més elevada en les fibres que expressen la cadena pesada de la miosina i que en las que expressen la cadena pesada de la miosina IIa o IIb. No es van trobar diferències entre les fibres IIa i IIb. Després de 2 setmanes d’entrenament, GLUT4 incrementà ~ 23% de fibres musculars de tipus i, però no hi hagué canvis en els tipus IIa o IIb. Tanmateix, l’exercici de baixa intensitat utilitzat és conegut principalment per reclutar fibres de tipus I.
D’acord amb els nostres resultats, l’entrenament de baixa intensitat originà una expressió major d’ARNm de GLUT4 en el múscul oxidatiu (és a dir, el soli), probablement degut a les necessitats relacionades amb la capacitat oxidativa de les cèl·lules. D’altra banda, la pràctica d’exercici d’alta intensitat no produí una expressió major d’ARNm de GLUT4 en el soli ni en el gastrocnemi. Com que el múscul gastrocnemi consisteix en una barreja de fibres vermelles i blanques, una altra explicació podria ser que l’entrenament amb exercicis de baixa intensitat no fou suficient per exercir o fins i tot per activar les fibres vermelles del múscul gastrocnemi, i un augment no significatiu d’aquest múscul podria procedir de les fibres blanques. Aquest escenari pot ampliar-se al que s’ha observat en les troballes relacionades amb l’alta intensitat; és a dir, un augment no significatiu d’aquest múscul amb l’exercici d’alta intensitat podria procedir només de les fibres vermelles.
Les hormones també regulen la concentració de la proteïna del múscul transportador de la glucosa. L’expressió de GLUT4 s’incrementà degut a la insulina i a les hormones tiroidees20,43 i disminuí per un AMPc elevat44. La regulació de l’expressió de GLUT4 per l’activitat contràctil és independent de la regulació hormonal, perquè la carrera en la cinta de córrer augmentà el GLUT4 en els ratolins diabètics45. S’hi afegiren els efectes de la deficiència de la insulina i denervació en les concentracions de GLUT445.
L’entrenament físic també augmenta la proteïna del GLUT4 i l’ARNm muscular en pacients amb diabetis tipus 246. Aquests resultats suggereixen que l’activitat contràctil del múscul modula directament l’expressió de GLUT4 del múscul, independentment de l’acció de la insulina. La histona deacetilasa 5 (HDAC5) és un mediador crític dels canvis del nivell d’ARNm de GLUT4 en resposta a l’entrenament47. S’ha demostrat que una sèrie de modificacions de les histones causades per la histona deacetilasa i la histona metiltransferasa culminaran en una caiguda metabòlica del gen GLUT4 en el múscul esquelètic dels ratolins48.
Hi ha evidències significatives que els nivells d’ARNm de GLUT4 disminueixen en el múscul del teixit adipós amb l’obesitat49,50, y que l’augment d’ARNm de GLUT4 pot alleujar o compensar la resistència a la insulina51,52. Tal com era d’esperar, les nostres troballes sobre els nivells d’ARNm del GLUT4 augmentaren significativament amb l’entrenament, i aquest increment s’associà a una pèrdua de pes, la qual cosa recolza aquesta idea. Per tant, l’augment de la transcripció de GLUT4 en el múscul durant la pèrdua de pes pot ser una prova definitiva en la reversió de la resistència a la insulina.
Estudis anteriors, juntament amb els nostres resultats, suggereixen que la regulació transcripcional del gen GLUT4 és sensible a canvis en l’equilibri d’energia del cos. A més, nosaltres vam trobar una resposta de GLUT4 a l’entrenament depenent de la intensitat i del tipus de fibra, que no es plantejava en estudis anteriors.
Podem concloure que tot tipus d’alteració de l’equilibri energètic del cos, especialment per la pràctica d’exercici i/o dieta alta en greixos, pot influir en els mecanismes moleculars i cel·lulars que actuen per establir una homeòstasi estable. GLUT4 podria disminuir si s’augmentés la ingesta d’energia, i a la inversa, augmentaria si s’augmentés la despesa energètica. Aquests canvis són gairebé similars en els músculs de contracció lenta i ràpida, amb una mica més de capacitat de resposta en els músculs de contracció lenta, perquè estan més compromesos amb el metabolisme de la glucosa.
Conflicte d’interessos
Els autors declaren que no tenen cap conflicte d’interessos
Agraïment
Els autors agraeixen a la Universitat de Guilan el suport econòmic atorgat a aquest projecte d’investigació.
Rebut el 10 d’octubre de 2015;
acceptat el 14 de desembre de 2015
* Autor per a correspondència.
Correu electrònic:mohebbi-h@yahoo.com (H. Mohebbi).