La tendinopatía es una lesión frecuente que se produce durante la práctica deportiva.
El reparto desigual de la carga de trabajo a lo largo del tendón produce roturas heterogéneas en extensión y distribución. Estas roturas ponen en marcha procesos de reparación defectuosos que producen un tendón degenerado con alteración estructural y de la respuesta funcional al ejercicio.
En este trabajo se estudian y analizan los distintos factores predisponentes, mecanismos de acción de los agentes químicos y celulares implicados en la fisiopatología de la tendinopatías.
Por otra parte, se analizan los componentes básicos (soporte, células y sustancias químicas) que se usan para la ingeniería tisular. Las posibilidades actuales de uso de los componentes básicos y sus interrelaciones, y el nivel actual de desarrollo.
Tendinopathy is a common condition that occurs while practising sport.
The unequal distribution of the work load throughout the tendon causes heterogeneous ruptures in extension and distribution. These ruptures start defective repair processes that produce a degenerated tendon with a change in structure and functional response to exercise.
In this article the different predisposing factors are study, along with the mechanisms of action of the chemical and cellular agents involved in the physiology of tendinopathies.
The basic components (support, cells and chemical substances) that are used for tissue engineering are also analysed, as well as the current possibilities of using the basic components, the inter-relationships between them and the current level of execution.
Para valorar la transcendencia de la lesión del tendón en el mundo del deporte diremos que la afectación tendinosa es una patología frecuente durante la práctica deportiva. La frecuencia es, según diversos autores, de 30 a 50% de todas las lesiones deportivas1. Existen estudios que señalan que el 30% de los corredores sufren tendinopatías crónicas y un 40% presentan codo de tenista en los deportes de raqueta2. La afectación degenerativa del tendón de Aquiles es la más frecuente (56,6%) en los corredores de fondo, está relacionada con el número de años de práctica de la carrera y es más frecuente en la porción media del tendón3.
La tendinopatía del manguito de los rotadores es la causa más frecuente de dolor y disfunción a nivel del miembro superior y aumenta su aparición con la edad4.
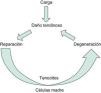
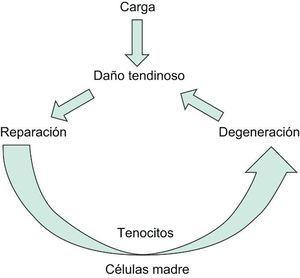
FisiopatologíaDurante la actividad física, desde el punto de vista etiopatogénico y biomecánico, la carga que actúa sobre el tendón produce una rotura fibrilar cuando la tracción mecánica supera el 4% de la longitud en reposo, siendo una rotura completa si supera el 4%. El reparto desigual de la carga a lo largo del tendón produce roturas heterogéneas en extensión y distribución. Por otra parte, debido a la distinta proporción de las uniones cruzadas entre las fibras de colágeno según la región tendinosa (zona músculo tendinosa, porción media, zona osteotendinosa) es diferente la resistencia mecánica, el perfil bioquímico y estructural del tendón5,6.
Estas roturas parciales o fibrilares ponen en marcha los mecanismos de reparación tendinosa, en los que están implicados:
a) Diversas sustancias químicas entre ellos los factores de crecimiento.
b) Células como los tenocitos residentes que se ocupan del balance, producción y destrucción de la matriz extracelular, también las células madres que se van a diferenciar en tenocitos, adipocitos, en línea condrogénica u osteogénica dependiendo entre otros factores de la carga mecánica que reciba durante el proceso de reparación.
c) La matriz extracelular que tiene como componente fundamental las fibras de colágeno tipo i 6,7.
Estos procesos de reparación defectuosos producen un tendón degenerado con alteración estructural. Esta regeneración defectuosa se ha relacionado con niveles de hipoxia a nivel de la lesión, presencia de un daño isquémico, apoptosis desigual mediada por citoquinas y mediadores inflamatorios, existencia de un estrés oxidativo, presencia de hipertermia local y una alteración del balance de las metaloproteinasas (MMP) de la matriz.
Las interacciones químicas en la matriz, los depósitos insolubles, la tensión mecánica, la liberación local de citoquinas y de moléculas de señalización tendrán efecto directo en la actividad del tenocito, en la expresión de los genes celulares y en los enzimas de la matriz.
El tenocito tiene un papel fundamental en la homeostasis normal, en la regularización de la matriz y del cambio patológico que sucede durante la enfermedad degenerativa, además parece que tiene un papel transcendental en la producción inadecuada de tejido durante reparación del fibrocartílago en el desarrollo de las tendinopatías8.
Todos estos procesos generan un tendón degenerado y fibrótico por lo que disminuye la capacidad para soportar carga. Se cierra de esta manera el círculo fisiopatológico de las tendinopatías (Figura 1).
Figura 1. Fisiopatología de la tendinopatía.
Factores predisponentesLa aparición de las tendinopatías va a depender de unos factores intrínsecos del propio deportista y extrínsecos.
Factores intrínsecos: se ha demostrado la presencia del gen variante de la tenascina C (TNC) y variantes del gen de colágeno v alfa1 (COL5A1)9; la mala alineación de los miembros inferiores con varo/valgo, recurvatum; la eversión del tobillo en corredores favorece la aparición de la tendinopatía aquilea10,11; cambios en la biomecánica normal articular con alteración de la longitud tendinosa, modificación de la relación grosor/potencia muscular en el caso de la toma de anabolizantes, alteración del brazo de palanca con cambios en el momento de fuerza que hace que aumente la carga en un punto determinado del tendón.
Como factores extrínsecos al deportista podemos encontrar: los parámetros relacionados con la carga tanto en su intensidad como en la frecuencia; entrenamiento; realización del gesto técnico; periocidad para dejar tiempo de recuperación y de descanso del tendón; determinadas drogas (quinolonas, estatinas) por su interrelación con las metaloproteinasas (MMP) o en otros casos por interferir los mecanismos de reparación12,13. Las metaloproteinasas tienen un papel fundamental en la degeneración tendinosa14.
El mayor recambio del colágeno de la matriz extracelular estuvo asociado con un aumento en la expresión y actividad de varios miembros de la familia de MMP. La MMP-3 (estromelisina) es considerada la enzima reguladora clave en el control del recambio de la matriz, su disminución podría representar una alteración en el proceso de remodelado normal. El estudio de líquido sinovial tendinoso mostró elevados niveles de expresión de MMP-1 y MMP-3, además un estudio molecular de la patología del tendón de Aquiles confirmó la ausencia de inflamación, con incrementos notables en la expresión de genes del colágeno tipo i y tipo iii , aumento de versican, biglicano, perlecan y de las glicoproteínas laminina, SPARC y tenascina-C. Los niveles de MMP-3 fueron menos abundantes o estuvieron ausentes en la tendinopatía dolorosa y en la ruptura del tendón. Fármacos como el ibuprofeno aumenta la expresión de la MMP1, 2, 8, 9 y 13 sin alterar la expresión de colágeno i y iii 15,16. Las fluoroquinolonas pueden inducir tendinopatías en algunos casos, dado que modulan la actividad MMP, también los corticoides aumentan el riesgo para padecer tendinopatías17.
La histología ha demostrado la alteración de la distribución normal de la curación, la ausencia de las células inflamatorias, la existencia de una pobre respuesta reparativa que condiciona una degeneración no inflamatoria intratendinosa de las fibras de colágeno provocando una desorientación y delgadez de las fibras con un aumento interfibrilar de glucosaminos, hipercelularidad y un crecimiento vascular disperso. Se ha observado la alteración de la matriz extracelular combinada con aumento de la expresión de proteoglicanos y aumento de la razón colágeno iii / i que aparece en las tendinopatías calcificantes18.
En las tendinopatías, a nivel de la estructura de la matriz extracelular existe: una reducción en el contenido total de colágeno, siendo la morfología anormal; una disminución de la densidad fibrilar y una alteración de la alineación19 con una mayor proporción de colágeno tipo iii con una organización al azar sobre el tipo i de estructura más alineada y organizada; aumento de proteoglicanos en los tendones con proceso degenerativo; acumulación de tejido necrótico y de fibrina; aumentan las glicoproteínas como la tenascina C; y un deterioro gradual de la calidad del tendón.
Por otra parte, la medición de los factores de crecimiento ha demostrado que:
a) El Insulin Growth Factor 1 (IGF I) ayuda a la proliferación y migración de fibroblastos e incrementa la producción de colágeno.
b) El Transforming Growth Factor beta (TGB beta) regula la migración celular, la proliferación de las uniones cruzadas y la remodelación de la matriz20.
c) El Vascular Endothelial Growth Factor (VEGF) es un potente estimulador de la angiogénesis. La demostración del aumento de la cantidad de VEGF en los tenocitos intrínsecos sugiere un papel del VEGF en la angiogénesis de la reparación del tendón. En tendones degenerados se puede detectar un aumento de los receptores de tipo 1 y 2 para los factores de crecimiento del endotelio vascular VEGF21,22 circunstancia que no sucede en los tendones normales.
d) El Platelet Derived Growth Factor (PDGF) estimula la producción de otros factores de crecimiento y tiene un papel en la remodelación tendinosa.
e) El basic Fibroblast Growth Factor (bFGF) es un potente estimulador de la angiogénesis también regula la proliferación y migración celular23,24. Los tenocitos proliferan en cultivo cuando están expuestos al bFGF25.
En relación al dolor que presentan las tendinopatías, se ha demostrado que aumenta en dos veces la concentración de lactato intratendinoso. También existe aumento del neurotansmisor glutamato y aumento de la PGE2 que se ha relacionado incluso con la aparición de la formación de calcificaciones. El nivel de sustancia P se ha vinculado con el nivel de dolor en la tendinopatía del manguito y codo26. En otros estudios se ha detectado un incremento de la expresión de la sustancia P y del gen relacionado con el péptido de la calcitonina (CGRP) en la reparación defectuosa y dolorosa del tendón27.
Por otra parte, en las tendinopatías existen evidencias histológicas del crecimiento neural a nivel intratendinoso y del paratendon que está regulado por mediadores pro y antiinflamatorios de la periferia del tendón durante el proceso de reparación. Este hecho depende del tiempo de reparación, de aspectos sensitivos, autonómicos y de mediadores de glutamatérgicos, sin embargo en los tendones normales solo se observa presencia de nervios a nivel del paratendon que refleja la normal homeostasis del tendón27,28.
En resumen existen evidencias clínica, histológicas y bioquímicas de la alteración de la homeostasis del tendón durante el proceso de regeneración y reparación después de una rotura fibrilar postejercicio.
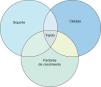
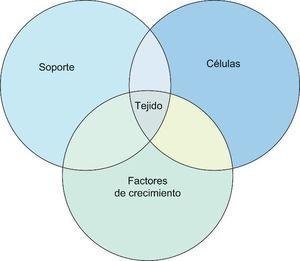
Ingeniería tisularDesde el punto vista teórico podemos considerar a cualquier tejido biológico compuesto por:
a) Un soporte o transportador (scaffold en inglés) que engloba las estructuras de sostén del tejido fundamentalmente compuesto por sustancias fibrilares.
b) Células que pueden poseer cualquier grado de diferenciación desde las indiferenciadas (células madres) hasta las más diferenciadas, como por ejemplo, los tenocitos maduros.
c) Sustancias químicas de distintos tipos entre ellos los factores de crecimiento. Estas sustancias químicas actúan como mensajeras intercelulares, intracelulares y autocrinas para mediar las diferentes respuestas celulares.
La ingeniería tisular, rama de la bioingeniería, intenta crear o producir tejidos para rellenar defectos tisulares. Para conseguir este fin parte del desarrollo o combinación de uno, dos o de los tres componentes mencionados previamente, así puede crear solo soporte para que sirva de andamiaje a las células del propio individuo o soporte con células para ser implantado en el defecto tisular como por el ejemplo el implante de matriz de colágeno con condrocitos autólogos cultivados (MACI), (Figura 2).
Figura 2. Areas de interés de la ingeniería tisular en la actualidad.
La presenta revisión señala posibilidades actuales que se están desarrollando dentro del campo de la ingeniería tisular para el tratamiento de las lesiones tendinosas, muchos de ellos solo están a nivel de modelo animal o in vitro.
Posibilidades actualesSoporteTambién como posibilidad actual se han usado soportes de biomateriales biocompatibles y biodegradables para rellenar defectos óseos29, también se ha creado una estructura de nanofibras electrospum que estimula la diferenciación de las células madres tendinosas30. En otros trabajos, han realizado el soporte con biocerámicas de ortofosfatos de calcio para rellenar los defectos de las inserciones tendinosas31. Por último, algunos utilizan estructuras de poliláctico en sus formas planares y en dos dimensiones por doble capa32.
Combinación de soporte y célulasPara aumentar la producción proteica fibrilar se ha realizado combinación de células fibroblásticas con el gel de polímero33. En otros casos a los tendones acelulares de cadáver se les ha implantado tenocitos cultivados para ser usados como injertos34. También en soporte de hidrogel se ha implantado células mesequimales35 incluso en soporte de intestino porcino se ha colocado los tenocitos cultivados36.
CélulasPara regeneración de tejido músculo tendinoso se ha utilizado el implante de células musculares sometidas a campos magnéticos de baja intensidad37. En el caso de rotura y defecto del manguito de los rotadores del hombro, se ha realizado implante con células que sintetizan glicoproteínas y lubricina38. Se ha elaborado técnica con tenocitos cultivados y crioconservados39 y en otros trabajos se han desarrollado células mesenquimales procedentes del tejido adiposo40.
Células y factores de crecimientoEn defectos tendinosos se han utilizado células mesenquimales de médula ósea más factores de crecimiento41. Otros investigadores han manejado a las células madres embriológicas humanas más factor de diferenciación fetal para la curación tendinosa42. En casos de fallos en la inserción tendinosa se ha estudiado la posibilidad del implante de las células madres mesenquimales con plasma rico en plaqueta tamponado (bPRP) que aumenta la proliferación y diferenciación a la línea condrogénica, este trabajo ha sido realizado in vitro43.
Factores de crecimientoEn un centro de investigación utilizan un birreactor para favorecer la curación y las propiedades mecánicas de los tendones44. Otros manejan una proteína soluble para estimular la regeneración músculo esquelética45. El basic Fibroblast Growth Factor (bFGF) como factor de crecimiento más conocido se ha usado para estimular la diferenciación de las células madres mesenquimales (MSC) del tendón46.
Factores de crecimiento más soporteTambién como posibilidad actual se han usado el colágeno tipo i combinado con el condroitín 6 sulfato como sustancia que favorece la estimulación de las células madres mesenquimales autólogas para la reparación tendinosa47. EL b FGF en soporte fibroso biohíbrido (nano y micro) para ligamento cruzado anterior de la rodilla y para la afectación tendinosa48. Los factores de crecimiento del plasma enriquecido más soporte sintético puede aumentar la proliferación y síntesis de las células tendinosas (in vitro)49. Las nanofibras con gradiente mineral para la inserción tendinosa50.
Células más factores de crecimiento y soporteSe están utilizando y manipulando los tejidos autólogos y heterólogos, para realizar autoinjerto o alonjerto modificados por medio de la técnica de conservación.
En resumen, existen actualmente, distintos y variados procedimientos para conseguir la construcción de un tejido vivo. Estudios posteriores delimitarán qué método o procedimiento es más eficaz para una determinada lesión tendinosa y se establecerán las indicaciones de cada una de las posibilidades terapéuticas.
ConclusionesLa carga de trabajo sobre el tendón produce un daño de distribución e intensidad desigual que pone en marcha mecanismos de regeneración y reparación defectuosos en calidad a nivel de la matriz extracelular, celular y de los procesos bioquímicos por lo que disminuye la tolerancia del tendón al ejercicio físico.
Son necesarios más estudios para ajustar con más precisión para ajustar con más precisión el diagnóstico de la patología tendinosa, definir estrategías y establecer protocolos terapéuticos para conseguir restaurar la histología normal del tendón.
AgradecimientosAl Dr. Carlos Revilla por sus sabias y maestras indicaciones.
Recibido 23 Marzo 2010
Aceptado 30 Abril 2010
Corresponding author. drfernandezjaen@gmail.com