Introducción
Ensayos clínicos realizados con condroitín sulfato (Condrosan®)1-5, sulfato de glucosamina6-7 y ácido hialurónico (Hyalgan®)8-11 han puesto en evidencia por primera vez la posibilidad de que dichos compuestos, además de actuar como fármacos de acción sintomática lenta o SYSADOA (symptomatic slow acting drugs for osteoarthritis), puedan influir en el curso de la artrosis (frenando o retrasando la enfermedad), es decir, actúen como modificadores del curso de la enfermedad artrósica o S/DMOAD (structure disease modifying osteoarthritis drugs).
Existe experiencia en la utilización clínica de estos compuestos en patología condral en medicina del deporte a nivel sintomático. No obstante, no se realizan ensayos clínicos a doble ciego en el ámbito de la medicina del deporte. Por tanto, las evidencias concretas con fármacos condroprotectores proceden de ensayos clínicos realizados en pacientes artrósicos, datos que pueden extrapolarse a la medicina del deporte, dadas las similitudes existentes entre la patología condral en deportistas y en pacientes artrósicos. A continuación describimos las evidencias disponibles en artrosis con los siguientes fármacos.
Condroitín sulfato
El condroitín sulfato forma parte del grupo de los glucosaminoglucanos, que son importantes constituyentes estructurales de la matriz extracelular del cartílago. Los condrocitos son las células responsables de la síntesis de los diferentes componentes de esta matriz, y de la homeostasis y catabolismo del cartílago. El condroitín sulfato está presente principalmente en la matriz extracelular que rodea estas células y es más abundante en los tejidos con una gran matriz extracelular, como los que forman los tejidos conectivos del cuerpo, cartílago, piel, vasos sanguíneos, así como los ligamentos y los tendones.
El cartílago articular es un tejido muy especializado con una matriz extracelular particularmente grande, con más del 98% del volumen de su matriz y menos del 2% de células. Las propiedades de resistencia al peso que el tejido posee se deben, esencialmente, a la integridad y a la estructura de la matriz. Las propiedades físicas del tejido pueden entenderse ampliamente en términos de la contribución realizada por el colágeno fibrilar y los proteoglucanos no fibrilares. Esencialmente, los glucosaminoglucanos del cartílago constituyen estos agregados de alto peso molecular (proteoglucanos) cuya forma principal se llama agrecán.
Los proteoglucanos contribuyen a aportar al cartílago sus propiedades mecánicas y elásticas. Gracias a la propiedad de retención de agua los proteoglucanos permiten que el cartílago articular se estire cuando se encuentra sometido a fuerza mecánica. Así, el cartílago articular constituye una superficie fuerte y elástica como soporte de la carga, y estas características dependen de la integridad de la red de colágeno y la retención dentro de ésta de una elevada concentración de agrecán rico en condroitín sulfato.
En las enfermedades articulares degenerativas, tales como la artrosis y otras patologías condrales, se produce un deterioro y una pérdida del cartílago articular. Una fase clave en el proceso degenerativo es la pérdida de proteoglucano del cartílago y la exposición de su red de colágeno a un mal funcionamiento mecánico.
Puede admitirse que la degradación de proteoglucanos tiene lugar en la matriz como consecuencia de una elevada actividad de las metaloproteinasas neutras activadas de una forma latente a una forma activa (colagenasa, gelatinasa y estromelisina). Se ha observado que la actividad de la colagenasa y de la estromelisina está significativamente aumentada en la artrosis humana. Estas enzimas son secretadas y sintetizadas por los sinoviocitos, pero también por los condrocitos bajo el efecto "catabolito" de la interleucina 1. La interleucina 1 también induce la síntesis y secreción de la prostaglandina E2 por parte de los condrocitos. La prostaglandina E2 podría inhibir la síntesis de ADN y la proliferación de condrocitos in vivo12.
Además de la inhibición de la activación de las metaloproteinasas, hay una inhibición extracelular de metaloenzimas, que controla su actividad en los tejidos. Al menos 2 inhibidores tisulares de las metaloproteinasas (TIMP) han sido identificados y caracterizados en diversos tejidos, incluyendo el cartílago.
Bajo condiciones fisiológicas, la actividad proteolítica de estas proteinasas endógenas del tejido parece estar controlada por diversos inhibidores. La regulación de este sistema de metaloproteinasas podría ser un factor clave en la degradación de las macromoléculas del cartílago. Estudios recientes en cartílago artrósico humano indican un desequilibrio entre los valores de metaloproteinasas y el valor de TIMP.
Puede concluirse que la deficiencia de inhibidores específicos para controlar la actividad de las metaloproteinasas neutras podría conducir a una reducción de los proteoglucanos en la matriz.
Mecanismos de acción
La justificación para utilizar condroitín sulfato para el tratamiento de las patologías condrales se basa en datos experimentales obtenidos en modelos in vitro e in vivo (animales y pacientes artrósicos), los cuales han demostrado que los glucosaminoglucanos sulfatados exógenos poseen un efecto sobre el metabolismo de los condrocitos y sugieren una influencia positiva sobre el curso de las enfermedades degenerativas articulares inducidas experimentalmente.
La reducción de la proporción de síntesis de agrecanos y la disminución de la capacidad de reunir agregados de gran tamaño molecular que tienen lugar con el aumento de la edad en humanos ilustra un fallo progresivo de la función de reparación de las células del cartílago articular en humanos. Esta observación explica el aumento de la incidencia de la artrosis en la tercera edad.
Durante el proceso de la patología condral, el metabolismo del condrocito podría ser alterado por factores exógenos y endógenos en la matriz. Entre éstos, los glucosaminoglucanos sulfatados han demostrado poseer efectos específicos, que podrían influir favorablemente la restauración del cartílago o prevenir una mayor degradación de la matriz.
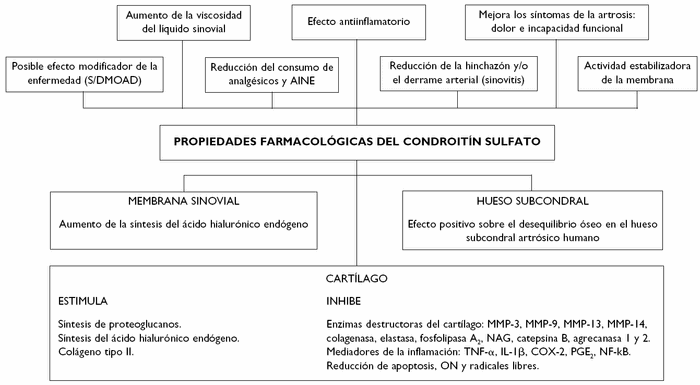
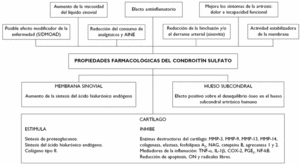
Los resultados de diversos estudios realizados in vitro y en animales sugieren que la acción terapéutica de condroitín sulfato se debe al menos a los siguientes mecanismos de acción: actividad antiinflamatoria en los componentes celulares de la inflamación, estimulación de la síntesis de proteoglucanos y ácido hialurónico endógeno, reducción de la actividad catabólica de los condrocitos (inhibiendo algunas enzimas proteolíticas tales como colagenasa, elastasa, proteoglucanasa, fosfolipasa A2, NAG, MMP-3, MMP-9, MMP-13, MMP-14, catepsina B y agrecanasa 1 y 2) y efecto protector de los componentes celulares del cartílago13 (fig. 1).
Figura 1 Efecto farmacológico del condroitín sulfato en el sistema osteoarticular.
Los efectos del condroitín sulfato sobre la síntesis de óxido nítrico (ON) a nivel articular, favorecedor de la degradación del cartílago, han sido evidenciados por el grupo de Blanco et al14, cuyos resultados ponen de manifiesto que el condroitín sulfato es capaz de reducir la síntesis de ON en los condrocitos articulares humanos artrósicos. Estos hallazgos están en consonancia con los del grupo de Chevalier (Francia), que observó que el condroitín sulfato reduce la apoptosis (muerte celular) inducida por ON en condrocitos de conejo.
Un trabajo reciente presentado en el XXXI Congreso Nacional de la Sociedad Española de Reumatología apunta acerca de un posible nuevo mecanismo de acción relacionado con el efecto positivo del condroitín sulfato sobre el desequilibrio óseo en el hueso subcondral artrósico15.
Toxicidad
Los estudios de toxicidad (aguda, subaguda y crónica), de mutagenicidad, de genotoxicidad, de carcinogénesis y de toxicidad sobre la reproducción, efectuados con condroitín sulfato, han dado en todos los casos resultados negativos.
El condroitín sulfato no posee toxicidad en sí mismo. No se cree que la administración exógena de condroitín sulfato de origen natural produzca toxicidad sistémica o genética, dado que forma parte de los componentes fisiológicos de los tejidos conectivos. La estructura del condroitín sulfato es idéntica a la del condroitín sulfato endógeno, sustancia natural del tejido conectivo humano.
El condroitín sulfato no ha inducido reacciones de tipo anafilactoide ni hipersensibilidad de tipo cutáneo en los tests realizados en conejos.
Toda esta seguridad demostrada en farmacología experimental ha sido confirmada en clínica a través de todos los ensayos clínicos, los metaanálisis y la farmacovigilancia realizada con el producto.
Seguridad
Los resultados de estudios clínicos publicados en la literatura, con una duración aproximada de 6 a 40 meses en un número limitado de pacientes, han mostrado una total ausencia de toxicidad de condroitín sulfato administrado oralmente en dosis de 1 a 2 g al día. Los efectos adversos registrados en estos estudios son menores y generalmente se asocian al tracto gastrointestinal al inicio del tratamiento, bajo forma de náuseas, pesadez gástrica, epigastralgias, diarreas, etc.
Hasta ahora, el condroitín sulfato está comercializado y se utiliza en distintos países europeos: en Suiza desde 1982, en Italia desde 1990, en Francia desde 1993, en Austria desde 1994, en Portugal desde 2000, en España desde 2002, así como en varios países de Europa del Este. Durante estos años, los estudios de farmacovigilancia jamás han revelado ningún efecto tóxico importante en el ser humano resultante de la utilización de este compuesto. Así pues, el hecho de que el condroitín sulfato se comercialice en varios países desde hace varios años y de que se hayan tratado varios millones de pacientes a escala mundial sin detectarse efectos adversos graves, confirma su gran perfil de seguridad.
El condroitín sulfato es una sustancia natural bien conocida que, según las evidencias presentadas, puede recomendarse como un tratamiento de acción sintomática lenta eficaz y seguro para la artrosis utilizado en la manera recomendada, como se ha demostrado en los ensayos clínicos realizados siguiendo las directrices del Committee for Proprietary Medicinal Products (CPMP), comité asesor de la Agencia Europea del Medicamento.
Las últimas recomendaciones de la Liga Europea Reumatológica (EULAR) para el tratamiento de la artrosis de rodilla hacen referencia a su elevado perfil de seguridad. En una escala del 0 al 100, se le atribuye un nivel de toxicidad de 6, por lo que constituye uno de los fármacos más seguros, junto al sulfato de glucosamina, para el tratamiento de la artrosis16.
En dichas recomendaciones también se constata el nivel de eficacia y seguridad de condroitín sulfato, al que se incluye dentro de la categoría 1A de mayor evidencia científica, con un grado de recomendación A, también el más elevado. A su vez, el reciente documento de consenso de la Sociedad Española de Reumatología sobre el tratamiento farmacológico de la artrosis de rodilla recoge el mismo grado de recomendación para el condroitín sulfato17.
Efecto clínico
Los ensayos clínicos en pacientes artrósicos demuestran que el tratamiento con condroitín sulfato produce la disminución o la desaparición de los síntomas de la enfermedad artrósica, como son el dolor y la impotencia funcional, mejorando el movimiento de las articulaciones afectadas, con un efecto que perdura durante 2 o 3 meses.
Dado que se trata de un SYSADOA, el inicio de acción de condroitín sulfato es algo lento, entre 2-3 semanas, aunque eventualmente alcanza la misma eficacia que los antiinflamatorios no esteroideos (AINE) y además presenta un efecto remanente por el cual su eficacia se mantiene hasta 2-3 meses después de la supresión del tratamiento18-19.
Eficacia y seguridad del condroitín sulfato frente al diclofenaco
Un ensayo clínico aleatorizado, multicéntrico, doble ciego, con 146 pacientes con artrosis de rodilla de al menos 6 meses de duración, comparó el diclofenaco tomado durante 30 días con el condroitín sulfato tomado durante 90 días20.
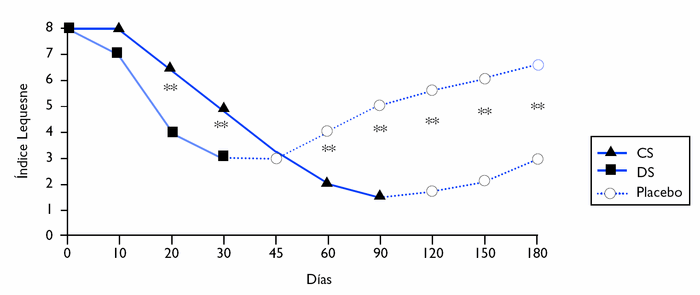
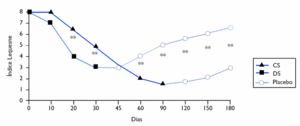
A partir del día 45 de estudio, el efecto del condroitín sulfato respecto al índice Lequesne fue semejante al del diclofenaco. No obstante, durante los meses 4.o, 5.o y 6.o, cuando los pacientes sólo tomaron placebo, el efecto disminuyó significativamente en el grupo del diclofenaco, mientras que el grupo del condroitín sulfato mantuvo su efecto positivo. Al cabo de los 6 meses, la puntuación en el grupo del condroitín sulfato fue un 64,4% inferior a los valores iniciales, y la del diclofenaco, un 29,7% (fig. 2).
Figura 2 Valores medios del índice Lequesne durante el estudio. CS: condroitín sulfato; DS: diclofenaco. ** p < 0,01.
La variable del dolor espontáneo (escala analógica visual, EAV) muestra un descenso progresivo y significativo en ambos grupos con una tendencia similar hasta el día 60. En los períodos posteriores los valores medios de dolor disminuyen considerablemente en los pacientes tratados con condroitín sulfato, que resultó ser una diferencia estadísticamente significativa entre los dos grupos durante los 4 meses finales de observación.
Teniendo en cuenta únicamente las medidas de dolor y funcionales, puede concluirse que el condroitín sulfato disminuye el dolor espontáneo con la misma eficacia que el diclofenaco. Sin embargo, a los 30 días de tratamiento, el efecto del condroitín sulfato es inferior al alcanzado con diclofenaco.
En definitiva, los pacientes tratados con AINE presentaron una reducción aguda y precoz de los síntomas clínicos que reaparecieron al suspender el tratamiento; en el grupo de condroitín sulfato la respuesta terapéutica apareció más tarde en el tiempo pero duró hasta 3 meses una vez finalizado el tratamiento.
Como conclusión, puede afirmarse que la eficacia clínica del condroitín sulfato fue parecida a la del diclofenaco, con la ventaja adicional de una mejor tolerancia y prolongación del efecto después de la supresión del tratamiento.
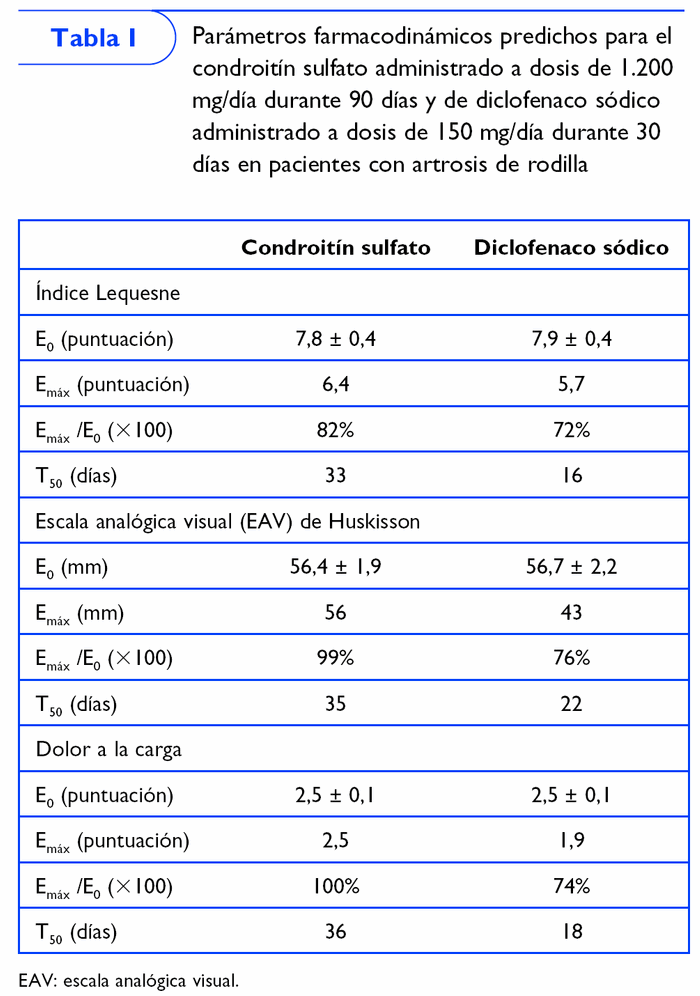
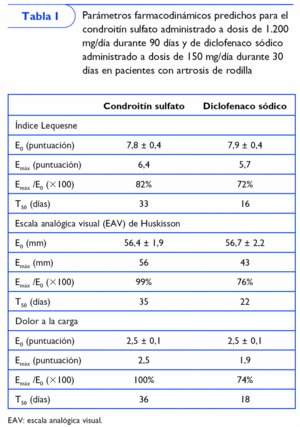
Otro estudio21 ha definido las características de la respuesta al condroitín sulfato durante y después de su administración, tomando como referencia el efecto de 150 mg de diclofenaco sódico (tabla I). Para este fin, se evaluaron varios ensayos clínicos aleatorizados, a doble ciego, controlados con placebo que incluían pacientes con artrosis de rodilla.
El efecto de condroitín sulfato sobre el estatus funcional (índice Lequesne), el dolor espontáneo (EAV de Huskisson) y el dolor a la carga fue evaluado utilizando el modelo Emáx. Esta metodología permite predecir el efecto máximo obtenible (Emáx) y el tiempo requerido para obtener el 50% de la Emáx (T50).
Los resultados de este estudio (tabla I) sugieren que la respuesta más favorable predicha en pacientes con artrosis de rodilla que han recibido 800 mg/día de condroitín sulfato durante 90 días es ligeramente superior a la predicha para el diclofenaco, aunque el condroitín sulfato tarda el doble en conseguir el efecto más favorable. No obstante, el efecto remanente del condroitín sulfato persiste el doble que el del diclofenaco.
Eficacia del condroitín sulfato frente a placebo
En total, 9 ensayos clínicos1-5,18,20,21, aleatorizados, a doble ciego, han comparado el efecto de condroitín sulfato frente a placebo en más de 1.000 pacientes con artrosis de rodilla y dedos, tratados durante períodos que oscilaron entre 3 y 36 meses.
Los resultados de todos los ensayos clínicos coinciden en concluir que el condroitín sulfato es más eficaz (aproximadamente el 50%, p < 0,05) que el placebo en reducir el dolor espontáneo, aumentar la capacidad funcional, disminuir la ingesta de medicación de rescate y en la valoración global del paciente y el investigador.
Asimismo, un metaanálisis22 recoge los datos de 7 ensayos clínicos suficientemente homogéneos como para ser analizados conjuntamente. Un total de 703 pacientes fueron incluidos en estos ensayos clínicos; 372 fueron tratados con condroitín sulfato, y 331, con placebo.
Los resultados mostraron que el condroitín sulfato era significativamente superior a placebo con respecto al índice Lequesne, la EAV del dolor y el consumo de medicación concomitante. Se observó una mejora significativa del índice Lequesne (p < 0,01 a 0,001), la EAV del dolor (p < 0,05 a 0,001) y el consumo de medicación concomitante (p < 0,05 a 0,01) en los pacientes tratados con condroitín sulfato a partir del día 60 y hasta el final del estudio (días 150 y 180, respectivamente), mientras que no hubo cambios en el grupo placebo.
Los datos recogidos confirmaron al menos una mejora del 50% en las variables del estudio en el grupo condroitín sulfato en comparación con la medicación control o placebo al final del estudio. Curiosamente, los efectos secundarios sucedieron más frecuentemente en los grupos placebo. Además, la tasa de abandono en todos los ensayos clínicos fue muy baja y no reveló diferencias significativas entre los estudios incluidos en el metaanálisis.
Los resultados de este metaanálisis permiten concluir que el condroitín sulfato puede ser una herramienta terapéutica eficaz para el tratamiento de la artrosis.
Cabe destacar un ensayo clínico23 reciente (GAIT: Glucosamine/Chondroitin Arthritis Intervention Trial), multicéntrico, aleatorizado y a doble ciego en un total de 1.583 pacientes con artrosis de rodilla realizado por el National Institutes of Health (NIH) de Estados Unidos, en el que se estudió el efecto de 5 tratamientos (500 mg de glucosamina 3 veces al día; 400 mg de condroitín sulfato 3 veces al día; 200 mg de celecoxib al día; 500 mg de glucosamina + 400 mg de condroitín sulfato 3 veces al día; placebo) sobre la reducción del dolor durante 6 meses. Los resultados mostraron que la glucosamina (64,0%), el condroitín sulfato (65,4%) o la combinación de ambos (66,6%) no produjeron una reducción significativa del dolor respecto a placebo (60%) en toda la población del estudio. Clegg et al23 manifestaron que esta falta de respuesta podría deberse a que la mayoría de los pacientes presentaba dolor leve (por tanto, poca capacidad de discernir mejoría en el dolor) y una respuesta del placebo muy superior (60%) a la esperada (35%). No obstante, un análisis exploratorio en el subgrupo de pacientes con dolor moderado a grave sugiere que la administración conjunta de condroitín sulfato (Condrosan®, Bioibérica) + glucosamina disminuye significativamente el dolor respecto a placebo (79,2% frente a 54,3%; p = 0,002) en pacientes con artrosis de rodilla; esta respuesta fue un 10% superior a la del control positivo (celecoxib).
En este mismo ensayo clínico se observó una disminución significativa de la hinchazón, acompañada o no de derrame articular (sinovitis), en el grupo tratado con condroitín sulfato, comparado con placebo (p = 0,01).
Clegg et al24, basándose en el mismo estudio (GAIT), también evaluaron si el condroitín sulfato podría tener un efecto diferencial sobre los síntomas de la artrosis en cuanto al grado radiográfico de Kellgren & Lawrence (KL) de los pacientes. Los resultados sugieren que el condroitín sulfato podría mejorar el dolor de la artrosis de rodilla en pacientes con fases iniciales de la patología, en concreto con grado 2 de KL.
Efecto modificador del curso de la enfermedad artrósica
Actualmente, la radiografía es el método más sencillo para identificar los cambios anatómicos de la articulación que confirman la existencia y el avance de la artrosis. En ella se observa un estrechamiento del espacio articular correspondiente a una pérdida de cartílago, esclerosis subcondral y formación de osteófitos, la respuesta ósea de la articulación al aumento de la carga mecánica resultante de la degeneración y pérdida de cartílago.
La facilidad con que pueden detectarse estas características mediante radiografía y su fácil interpretación han hecho que sea considerado el método principal para visualizar las articulaciones artrósicas. Actualmente también están ganando terreno otras técnicas de imagen, como la resonancia magnética (RM) o la ecografía.
El punto más estrecho del espacio articular tibiofemoral puede medirse en milímetros con una regla o calibrador, aunque el estrechamiento también puede graduarse de 0-3 en los compartimientos separados de la articulación de la rodilla, o de 4 a +4, o partir de una puntuación inicial de +1 registrando los cambios en el tiempo en forma de cambios ±1,0.
Paralelamente a los resultados que demuestran la eficacia sintomática del condroitín sulfato, también se ha evidenciado en 5 ensayos clínicos mediante técnicas radiográficas la posibilidad de que el condroitín sulfato pueda prevenir las lesiones articulares erosivas o retrasar la progresión de la lesión articular. A continuación resumimos los resultados de estos trabajos.
Dos ensayos clínicos aleatorizados, a doble ciego, controlados con placebo que incluyeron respectivamente 119 y 165 pacientes con artrosis de dedos tratados con condroitín sulfato durante 3 años, concluyeron que la progresión de la artrosis fue menor en el grupo de condroitín sulfato y, además, menos pacientes de este grupo desarrollaron artrosis erosiva. El criterio principal de evaluación del dolor fue una escala numérica de la evolución anatómica de la artrosis de dedos, que se determinó mediante radiografías posteroanteriores de las articulaciones interfalángicas y metacarpofalángicas. Mediante el análisis de las modificaciones en las fases anatómicas de cada paciente se evidenció que un número significativo de pacientes de ambos grupos desarrolló artrosis en articulaciones previamente no afectadas. No obstante, en el grupo tratado con condroitín sulfato se observó una disminución significativa del número de pacientes con articulaciones afectadas4,5.
Otro ensayo clínico piloto aleatorizado, a doble ciego, estudió la evolución del espacio articular de la articulación femorotibial en 14 pacientes tratados con condroitín sulfato y 12 con placebo afectos de artrosis tibiofemoral. El tratamiento con 800 mg de condroitín sulfato durante un año indujo una estabilización del espacio articular tibiofemoral, medido por análisis de imagen digitalizada, mientras que se experimentó una reducción del espacio articular en los pacientes del grupo placebo1.
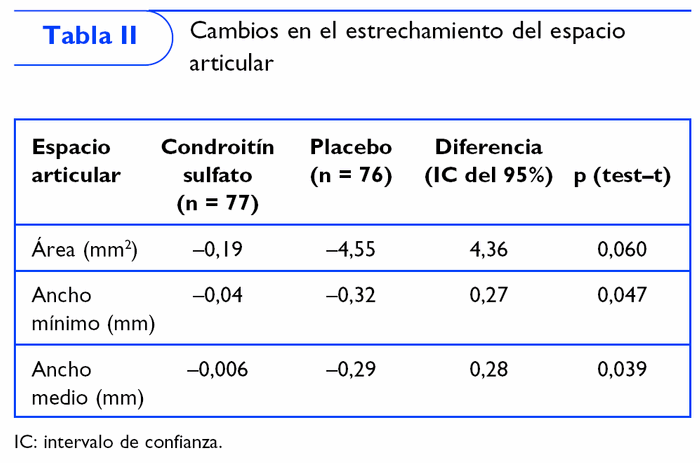
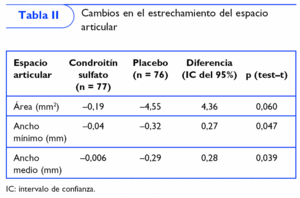
Se realizó otro ensayo clínico multicéntrico, aleatorizado, a doble ciego, controlado con placebo de 1 año de duración en 110 pacientes con artrosis de rodilla en el que se administraron 800 mg/día de condroitín sulfato realizando 2 ciclos de 3 meses de tratamiento alternados por 3 de descanso. Al cabo de un año se observó que el espacio articular femorotibial disminuyó significativamente en el grupo placebo, mientras que se mantuvo inalterable en el grupo del condroitín sulfato6 (tabla II).
Recientemente, un nuevo ensayo clínico aleatorizado, a doble ciego, controlado con placebo de 2 años de duración que incluyó 300 pacientes con artrosis de rodilla, evidenció que la anchura y el grosor del espacio articular habían disminuido significativamente en el grupo placebo, mientras que permanecieron estables en el grupo condroitín sulfato3.
Los resultados citados sugieren que el condroitín sulfato, además de mejorar efectivamente la sintomatología de la artrosis de rodilla y dedos, posee propiedades modificadoras de la estructura que, aunque no reparan el daño provocado, sí son capaces de retrasar y mitigar la progresión de la enfermedad.
La excelente seguridad demostrada en toda la investigación clínica realizada con condroitín sulfato es de especial interés en un tratamiento crónico (tratamiento continuado y/o en ciclos) como es el de la enfermedad artrósica. Asimismo, también cabe destacar que el condroitín sulfato no es metabolizado por enzimas del citocromo P450, y ello es de gran trascendencia, ya que implica que el condroitín sulfato no puede presentar interacciones con otros medicamentos en el aspecto metabólico. Este punto es de especial relevancia para pacientes de la tercera edad polimedicados.
Además, el condroitín sulfato presenta la ventaja de ser un fármaco mucho más seguro que la terapéutica clásica utilizada, pues no presenta efectos adversos gastrointestinales, hepáticos, renales o cardiovasculares como la mayoría de AINE, por lo que puede administrarse de forma crónica como esta patología requiere, actuando como tratamiento de base. Además, su utilización puede suponer una reducción del consumo de analgésicos y AINE o gastroprotectores18,22. Por otra parte, las características de su efecto remanente hacen también posible que puedan pautarse ciclos con y sin tratamiento de manera intermitente para favorecer una mayor comodidad y calidad de vida al paciente.
Podemos concluir que el condroitín sulfato es un fármaco de acción sintomática lenta eficaz y seguro para el tratamiento de la artrosis que ha demostrado mejorar el dolor y la incapacidad funcional en todos los ensayos clínicos realizados al respecto con una eficacia similar a la del diclofenaco y una superioridad >50% frente al placebo.
Por todo lo anterior, puede afirmarse que el condroitín sulfato hoy por hoy puede considerarse uno de los tratamientos de base de dicha patología.
Sulfato de glucosamina
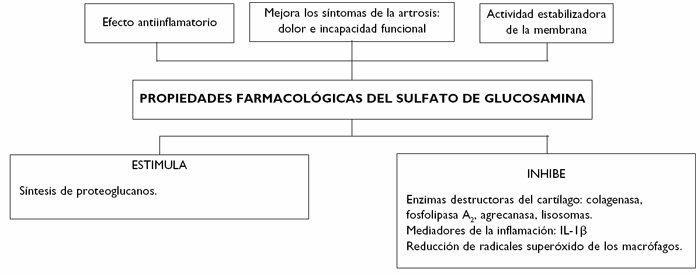
El sulfato de glucosamina es un principio activo de origen biológico presente en el organismo humano y sintetizado a partir de la quitina que se extrae de las conchas y/o caparazones de crustáceos. La glucosamina es un aminomonosacárido natural y es el sustrato para la biosíntesis de los proteoglucanos del cartílago.
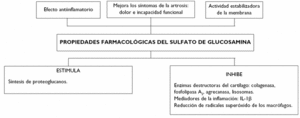
Se ha demostrado la actividad del sulfato de glucosamina sobre la síntesis de proteoglucanos en los cartílagos articulares25. Asimismo, posee una actividad antiinflamatoria independiente de la ciclooxigenasa; de ahí la buena tolerancia gastrointestinal y general de la glucosamina.
Además, ha demostrado inhibir algunas enzimas destructoras del cartílago, tales como colagenasa, agrecanasa, fosfolipasa A2 y enzimas lisosomales, y la formación de otras sustancias que dañan los tejidos, como los radicales superóxido de los macrófagos.
Estas acciones pueden explicarse por una actividad estabilizadora de la membrana, posiblemente conectada con las citadas propiedades metabólicas del producto.
Los efectos sobre la síntesis de óxido nítrico (ON), favorecedor de la degradación del cartílago, no están totalmente claros: algunos grupos han encontrado que disminuye la síntesis de ON26, mientras que otros no han encontrado efecto alguno (fig. 3)14.
Figura 3 Efecto farmacológico del sulfato de glucosamina en el sistema osteoarticular.
Todo ello explica su actividad beneficiosa en los procesos de la patología condral y, en particular, sobre los síntomas de la enfermedad.
En el aspecto estrictamente especulativo, se ha comentado que la eficacia del condroitín sulfato pueda deberse a su conversión en sulfato de glucosamina, dado que la estructura química de ambas moléculas es parecida. No obstante, es importante clarificar que de la molécula de condroitín sulfato (integrada por un 55% de condroitín sulfato 4, un 40% de condroitín sulfato 6 y un 5% de condroitín sulfato 4,6), teóricamente sólo el condroitín sulfato 6 puede transformarse en sulfato de glucosamina, y se desconoce en qué proporción. No obstante, aunque fuera el total de su proporción, lo cual resulta improbable, ésta equivaldría a una dosis 5 veces inferior a la terapéutica de glucosamina (1.500 mg), por lo que el argumento de que la eficacia del condroitín sulfato se deba a su conversión en glucosamina carece de fundamento científico.
Dado que se trata de un SYSADOA, el inicio de acción del sulfato de glucosamina es lento, entre 2 o 3 semanas, aunque eventualmente alcanza la misma eficacia que los AINE y, además, presenta un efecto remanente por el cual su eficacia se mantiene hasta 2 meses después de la supresión del tratamiento.
Como se ha comentado anteriormente, en un reciente ensayo clínico publicado por Clegg et al23 se ha demostrado que la combinación de condroitín sulfato más glucosamina en pacientes con artrosis de rodilla y con dolor moderado o intenso consigue una mejoría estadísticamente significativa del dolor inicial comparativamente con el grupo placebo.
Ácido hialurónico
El ácido hialurónico pertenece a la familia de los glucosaminoglucanos y se encuentra en diversos tejidos extracelulares, incluyendo el líquido sinovial, la matriz extracelular de la piel y el cartílago.
En las articulaciones, el ácido hialurónico es producido por los condrocitos y los sinoviocitos. El ácido hialurónico constituye el eje central de varios agregados de proteoglucanos necesarios para la integridad funcional del cartílago. Es uno de los componentes principales de la matriz extracelular del cartílago y de las capas superficiales de la membrana sinovial, y está presente en elevadas concentraciones en el líquido sinovial.
En los pacientes con patología condral, el ácido hialurónico del líquido sinovial se despolimeriza, dando como resultado una disminución del peso molecular y la viscoelasticidad, aumentando la susceptibilidad del cartílago a la lesión.
El ácido hialurónico proporciona viscoelasticidad al líquido sinovial, fundamental para sus propiedades de lubricante y amortiguador, y esencial para la correcta estructura de los proteoglucanos en el cartílago articular. En numerosas patologías condrales la cantidad de ácido hialurónico en el líquido sinovial y en el cartílago es insuficiente y su calidad está alterada.
La administración intraarticular de ácido hialurónico mejora la movilidad de las articulaciones con superficie del cartílago degenerativa y alteraciones en el líquido sinovial. Existen varios ácidos hialurónicos que pueden o no tener los mismos efectos clínicos debido a su distinta procedencia, distinta concentración, distinta posología y, sobre todo, distintos pesos moleculares27.
El ácido hialurónico de 500-730 kDa (Hyalgan®) ha demostrado que su eficacia terapéutica se debe a la combinación de sus propiedades tanto mecánicas (viscosuplementación) como farmacológicas; de ahí su aprobación como medicamento frente al resto de ácidos hialurónicos que están disponibles como implante.
Para entender el mecanismo de acción del ácido hialurónico se ha definido el término "viscosuplementación" utilizado para la mayor parte de ácidos hialurónicos de alto peso molecular para la recuperación de las propiedades viscoelásticas del líquido sinovial.
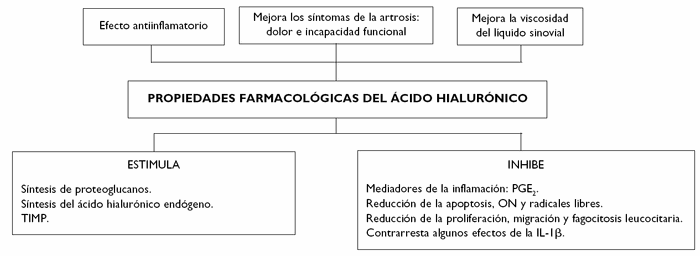
Por otra parte, estudios in vitro e in vivo indican que el ácido hialurónico con peso molecular de 500-730 kDa puede influir en la inflamación por actuar sobre determinados radicales libres del oxígeno, por inhibir la proliferación, la migración y la fagocitosis leucocitaria, y por inhibir la prostaglandina E2 (PGE2) y el óxido nítrico (ON). El ácido hialurónico a este peso molecular también reduce la apoptosis en el cartílago artrósico y contrarresta algunos de los efectos de la interleucina 1 (IL-1). Asimismo, la inyección intraarticular de Hyalgan® estimula la síntesis de ácido hialurónico endógeno y de TIMP-127-29 (fig. 4).
Figura 4 Efecto farmacológico del ácido hialurónico en el sistema osteoarticular.
Debido a su distinta procedencia, concentración, posología y peso molecular, no se puede afirmar que los distintos ácidos hialurónicos sean bioequivalentes desde un punto de vista terapéutico.
En un estudio comparativo entre un ácido hialurónico de 500-730 kDa y otro de 6.000 kDa, se observó que el primero era capaz de reducir en un 70% los niveles de ON inducido por IL-1 y en un 45% la síntesis de PGE2 inducida por IL-1, a diferencia del ácido hialurónico de más alto peso molecular. Los dos ácidos hialurónicos demostraron reducir la apoptosis inducida por el ON en un 40 y 36%, respectivamente29.
Por otra parte, tras comparar los resultados experimentales de estudios in vitro e in vivo con ácidos hialurónicos de distintos pesos moleculares, los resultados indican que mientras los estudios in vitro mostraban generalmente que los ácidos hialurónicos de alto peso molecular eran más activos biológicamente que los de menor peso molecular, este hecho no se confirmaba utilizando modelos animales de artrosis. La discrepancia podría explicarse en parte por la mayor penetración del ácido hialurónico de menor peso molecular a través de la matriz extracelular de la membrana sinovial, aumentando así su concentración y facilitando su interacción con las células sinoviales.
Los estudios que han utilizado modelos animales de artrosis han demostrado que los ácidos hialurónicos con un peso molecular en el rango de 500-1.000 kDa eran generalmente más eficaces en la reducción de los índices de inflamación sinovial y restauración de las propiedades del líquido sinovial que los ácidos hialurónicos con un peso molecular >2.300 kDa30.
Estas propiedades farmacológicas observadas con el ácido hialurónico de peso molecular 500-1.000 kDa podrían explicar el beneficio clínico a largo plazo de esta terapia y confirman la teoría de que no todos los ácidos hialurónicos son iguales.
En ensayos clínicos controlados, los ciclos de terapia con 5 inyecciones de ácido hialurónico de peso molecular 500-730 kDa han demostrado mejorar significativamente los síntomas de la artrosis, como son el dolor y la impotencia funcional, durante al menos 6 meses después de la finalización del tratamiento. En algunos casos la mejoría se ha evidenciado hasta 12 meses e incluso más31 (efecto remanente).
La articulación más estudiada ha sido la rodilla, y hay otros ensayos clínicos realizados en el hombro (omartrosis) y la cadera.
Un ensayo clínico multicéntrico realizado en Estados Unidos con 495 pacientes con gonartrosis, divididos en 3 grupos de tratamiento uno con ácido hialurónico de peso molecular 500-730 kDa, otro con placebo y un tercero con naproxeno puso en evidencia la eficacia y la seguridad de este ácido hialurónico en pacientes con gonartrosis y sirvió para que la Food and Drug Administration (FDA) aprobara su comercialización en Estados Unidos para el tratamiento de la artrosis de rodilla en pacientes que no responden a la terapia no farmacológica (educación del paciente, pérdida de peso, terapia física y ocupacional) o analgésica (paracetamol)32.
Un reciente metaanálisis de 24 ensayos clínicos publicados confirma la eficacia y la seguridad de este ácido hialurónico en el tratamiento de la artrosis de rodilla, así como en otras articulaciones, presentando además evidencias de una posible acción modificadora del curso de la enfermedad artrósica33.
Conclusiones
A partir de esta revisión acerca del tratamiento farmacológico de las condropatías, se puede confirmar que estos medicamentos (condroitín sulfato, sulfato de glucosamina y ácido hialurónico) son eficaces en el tratamiento sintomático de dichas patologías y son fármacos altamente seguros. Este último punto es clave en el tratamiento crónico de la patología condral, ya que se reducen los efectos adversos y las posibles interacciones con otros fármacos.
Existen además evidencias de que estas moléculas pueden actuar como modificadoras de la patología, llegando a retrasar el curso de la patología condral. Cabe destacar, sin embargo, que tendrán que confirmarse en ensayos clínicos actualmente en curso. Todo ello permite pensar que en los próximos años se podrá iniciar el estudio de la combinación de estas nuevas moléculas y su especialización a nivel de la articulación.
Correspondencia: Prof. Antonio García García. Servicio de Farmacología Clínica. Hospital Universitario de la Princesa. Facultad de Medicina. Universidad Autónoma de Madrid. Av. Arzobispo, 4. 28029 Madrid. España. Correo electrónico: agg@uam.es